Οι σημαντικότερες από αυτές είναι:
- Χειρουργική θεραπεία
- Χημειοθεραπεία, που έχει ως στόχο τη συρρίκνωση των καρκινικών κυττάρων
- Ορμονική θεραπεία, που έχει ως στόχο να αποκόψει τον καρκίνο από τη δυνατότητα να λαμβάνει τις ορμόνες εκείνες που χρειάζεται και διευκολύνουν την ανάπτυξή του
- Βιολογική θεραπεία, που έχει ως στόχο να ισχυροποιήσει το ανοσοποιητικό σύστημα, έτσι ώστε να το βοηθήσουν να αντιμετωπίσει τα καρκινικά κύτταρα
- Ακτινοθεραπεία (Radiation therapy), όπου μέσα από τη χρήση ακτίνων υψηλής ενέργειας γίνεται προσπάθεια να καταστραφούν τα καρκινικά κύτταρα.
Στο σημείο αυτό θα πρέπει να υπογραμμίσουμε ότι η αντιμετώπιση του καρκίνου του μαστού, όπως συμβαίνει και με πολλά άλλα πολύπλοκα νοσήματα, απαιτούν τη συνεργασία περισσότερων της μίας ειδικότητας γιατρών. Στη συγκεκριμένη πάθηση η συνεργασία ανάμεσα σε ογκολόγους, χειρουργούς και ακτινοθεραπευτές είναι τις περισσότερες φορές επιβεβλημένη.
Όσον αφορά τη συστηματική αγωγή, και σύμφωνα με τα όσα αναφέρονται στα Διαγνωστικά/Θεραπευτικά Πρωτόκολλα του Απριλίου 2019, ο κλινικά μη μεταστατικός καρκίνος του μαστού μπορεί να διακριθεί σε εγχειρήσιμη (κλινικά στάδια Ι, ΙΙ και ορισμένοι ΙΙΙΑ όγκοι) και μη εγχειρήσιμη νόσο (κλινικά στάδια ΙΙΙΒ, ΙΙΙC και ορισμένοι ΙΙΙΑ όγκοι). Οι πλέον βασικές παράμετροι, που συνυπολογίζονται στο σχεδιασμό της συστηματικής αγωγής, είναι η έκφραση των ορμονικών υποδοχέων, η έκφραση του HER2, η μασχαλιαία λεμφαδενική νόσος (Ν) και το μέγεθος του όγκου (Τ). Γενικά, η χημειοθεραπεία θα πρέπει να χορηγείται εντός 12 εβδομάδων από το χειρουργείο.
Στις σελίδες που ακολουθούν θα αναφερθούμε στα φάρμακα που χορηγούνται στον καρκίνο του μαστού και θα επικεντρωθούμε τόσο σε αυτά που αναφέρονται στα Διαγνωστικά/Θεραπευτικά Πρωτόκολλα, όσο και στις νεότερες θεραπείες. Λεπτομέρειες σχετικά με τους όρους κάτω από τους οποίους χορηγείται η εκάστοτε θεραπευτική αγωγή που αναφέρεται στις σελίδες που ακολουθούν, μπορείτε να δείτε στα Διαγνωστικά/Θεραπευτικά Πρωτόκολλα του Απριλίου 2019.
Χημειοθεραπεία
Στις περισσότερες περιπτώσεις, η χημειοθεραπεία έχει το καλύτερο δυνατό αποτέλεσμα όταν χρησιμοποιούνται περισσότερα από ένα φάρμακα ταυτόχρονα. Συχνά, χρησιμοποιούνται συνδυασμοί 2 ή 3 φαρμάκων.
Θα πρέπει να σημειώσουμε ότι οι γιατροί που είναι εξειδικευμένοι στην αντιμετώπιση του καρκίνου του μαστού, χρησιμοποιούν πολλούς διαφορετικούς συνδυασμούς και δεν είναι σαφές ότι κάποιος συγκεκριμένος συνδυασμός φαρμάκων είναι ο καλύτερος για όλους τους ασθενείς.
Επικουρική και νεο-επικουρική χημειοθεραπεία
Στην κατηγορία αυτή συμπεριλαμβάνονται, σύμφωνα πάντα με την «American Cancer Society»:
- Anthracyclines, όπως η Doxorubicin (Adriamycin) και Epirubicin (Ellence)
- Taxanes, όπως το Paclitaxel (Taxol) και Docetaxel (Taxotere)
- 5-Fluorouracil (5-FU) ή Capecitabine (Xeloda)
- Cyclophosphamide (Cytoxan)
- Carboplatin (Paraplatin).
Η επικουρική χημειοθεραπεία μπορεί να χορηγηθεί μετά τη χειρουργική επέμβαση, προκειμένου να εξοντωθούν τυχόν καρκινικά κύτταρα που ενδεχομένως έχουν «μείνει πίσω» ή έχουν εξαπλωθεί αλλά δεν μπορούν να φανούν ακόμη στις απεικονιστικές εξετάσεις.
Η νεο-επικουρική χημειοθεραπεία δύναται να χορηγηθεί στην προσπάθειά μας να συρρικνωθεί ο όγκος, έτσι ώστε να μπορεί να αφαιρεθεί με λιγότερο εκτεταμένη χειρουργική επέμβαση. Ακριβώς γι’ αυτό τον λόγο η νεο-επικουρική χημειοθεραπεία χρησιμοποιείται συχνά προκειμένου να αφαιρεθούν χειρουργικά όγκοι που είναι πολύ μεγάλοι όταν διαγνωστούν για πρώτη φορά ή είναι φλεγμονώδεις καρκίνοι του μαστού ή είναι πολλοί λεμφαδένες που εμπλέκονται με καρκίνο.
Εάν μετά τη χορήγηση νεο-επικουρικής χημειοθεραπείας εξακολουθούν να υπάρχουν καρκινικά κύτταρα όταν υλοποιηθεί η χειρουργική επέμβαση (residual disease – υπολειμματική νόσος), μπορεί να προσφερθεί στον ασθενή περισσότερη χημειοθεραπεία (επικουρική χημειοθεραπεία), προκειμένου να μειωθούν οι πιθανότητες επανεμφάνισης του καρκίνου (υποτροπή).
Χημειοθεραπευτικά φάρμακα που χορηγούνται στον μεταστατικό καρκίνο του μαστού
- Ταξάνες: Paclitaxel (Taxol), Docetaxel (Taxotere), καθώς και Albumin-bound Paclitaxel (Abraxane)
- Ixabepilone (Ixempra)
- Eribulin (Halaven)
- Ανθρακυκλίνες: Doxorubicin (Adriamycin), liposomal doxorubicin (Doxil) και epirubicin (Ellence)
- Παράγωγα πλατίνας (Cisplatin, carboplatin)
- Vinorelbine (Navelbine)
- Capecitabine (Xeloda)
- Gemcitabine (Gemzar)
- Συμπλέγματα φαρμάκου με αντισώματα: (Ado-trastuzumab emtansine [Kadcyla], Fam-trastuzumab deruxtecan [Enhertu], Sacituzumab govitecan [Trodelvy])
Θα πρέπει να σημειώσουμε ότι αν και συνδυασμοί φαρμάκων χρησιμοποιούνται συχνά για τη θεραπεία του πρώιμου καρκίνου του μαστού, ο προχωρημένος καρκίνος του μαστού συχνά αντιμετωπίζεται με συγκεκριμένα μεμονωμένα χημειο-θεραπευτικά φάρμακα. Επιπλέον, ορισμένοι συνδυασμοί φαρμάκων, όπως για παράδειγμα ο συνδυασμός Paclitaxel και Gemcitabine, συχνά χορηγούνται για την αντιμετώπιση του μεταστατικού καρκίνου του μαστού.
Σύμφωνα με μια έκθεση του CADTH, που δημοσιεύτηκε τον Οκτώβριο του 2018, το ποσοστό πενταετούς επιβίωσης συνολικά από τον καρκίνο του μαστού των γυναικών στον Καναδά που υπόκεινται σε θεραπεία, είναι σχετικά υψηλό και ανέρχεται στο 87%. Ωστόσο, αυτό οφείλεται σε μεγάλο βαθμό στους καρκίνους πρώιμου σταδίου Ι και ΙΙ, οι οποίοι αποτελούν περισσότερο από το 80% όλων των καρκίνων του μαστού στις γυναίκες. Το ποσοστό πενταετούς επιβίωσης μειώνεται στο 24% για τους καρκίνους που έχουν δώσει μετάσταση σε άλλους ιστούς, ενώ η διάμεση επιβίωση για τις γυναίκες με καρκίνο του μαστού σταδίου IV είναι 18 έως 24 μήνες. Η μετάσταση στο ήπαρ σχετίζεται με μια ιδιαίτερα κακή πρόγνωση και η χειρουργική επέμβαση θεωρείται η μόνη θεραπεία. Ωστόσο, μόνο το 20% των ασθενών είναι επιλέξιμοι για τη χειρουργική επέμβαση. Χωρίς θεραπεία, η διάμεση επιβίωση για ασθενείς με καρκίνο του μαστού που έχουν υποστεί ηπατικές μεταστάσεις είναι περίπου έξι μήνες.
Η συστημική θεραπεία είναι η τυπική θεραπεία για τον μεταστατικό καρκίνο του μαστού. Ωστόσο, η τοπική ή περιφερειακή-περιοχική διαχείριση (local or regional) του πρωτοπαθούς όγκου και της περιφερειακής νόσου μπορεί να προσφερθεί ως ανακουφιστική θεραπεία σε ορισμένες περιπτώσεις, όταν δεν μπορεί να πραγματοποιηθεί χειρουργική επέμβαση. Υπάρχουν πρώιμα στοιχεία από μελέτες, που υποδηλώνουν ότι η τοπική θεραπεία μπορεί να παρατείνει την επιβίωση, αν και απαιτείται περαιτέρω έρευνα για την υποστήριξη της ευρείας χρήσης για τον σκοπό αυτό.
Είναι σημαντικό να επισημάνουμε τη σημαντική εξέλιξη της επιστήμης τα τελευταία χρόνια που αφορά την εξατομίκευση της θεραπείας, όπως καθορίζεται από τα ξεχωριστά ποιοτικά χαρακτηριστικά κάθε όγκου. Είναι πλέον γενικά αποδεκτή η άποψη ότι κάτω από τον όρο «καρκίνος του μαστού», όπως εξάλλου και για άλλες μορφές καρκίνου, περιλαμβάνονται νοσήματα με διαφορετική κλινική πορεία, διαφορετική απόκριση στις θεραπείες και καθεμιά από αυτές απαιτεί διαφορετική θεραπευτική στρατηγική.
Η τοπική ή περιοχική χημειοθεραπεία – ακτινοθεραπεία χρησιμοποιείται μαζί με τη χειρουργική επέμβαση για την αφαίρεση του όγκου. Η ενδοαρτηριακή χημειοθεραπεία, π.χ., ή η χημειοθεραπεία με ηπατική αρτηριακή έγχυση, παρέχει χημειοθεραπεία υψηλής δόσης, ή βιολογικούς παράγοντες, σε μεταστατικούς όγκους μέσω ενός προσωρινού και πλήρως απομονωμένου κυκλώματος αιμάτωσης αγγειακής κυκλοφορίας. Για παράδειγμα, η χημειοθεραπεία με ηπατική αρτηριακή έγχυση έχει σχεδιαστεί για να αξιοποιήσει την πρωτογενή παροχή αίματος στις ηπατικές μεταστάσεις, η οποία παρέχεται μέσω της ηπατικής αρτηρίας (ενώ ο μη καρκινικός ηπατικός ιστός τροφοδοτείται μέσω του συστήματος της πυλαίας κυκλοφορίας). Ο στόχος της χημειοθεραπείας με ηπατική αρτηριακή έγχυση είναι να μεγιστοποιήσει τις συγκεντρώσεις του φαρμάκου στο ήπαρ, διατηρώντας παράλληλα τη συνολική συστηματική έκθεση χαμηλή, ελαχιστοποιώντας έτσι την τοξικότητα και τις ανεπιθύμητες ενέργειες του χορηγούμενου φαρμάκου.
Στις σελίδες που ακολουθούν θα παραθέσουμε χρονολογικά, από τα παλαιότερα προς τα νεότερα, όλα τα φάρμακα που το National Cancer Institute των ΗΠΑ αναφέρει ότι χορηγούνται για την αντιμετώπιση του καρκίνου του μαστού. Θα πρέπει να σημειώσουμε ότι για τα παλαιότερα φάρμακα που είχαν εγκριθεί πριν από τη δημιουργία του EMA και για τα οποία δεν έχει γίνει ανασκόπηση από τον ΕΜΑ, αλλά κυκλοφορούσαν στη χώρα μας από τον ΕΟΦ, με αμοιβαία ή αποκεντρωμένη διαδικασία, παραθέτουμε στοιχεία από τα αντίστοιχα SPC του ΕΟΦ.
Πίνακας φαρμάκων για τον καρκίνο του μαστού
Σχεδιάγραμμα 1: Χρονολογική σειρά έγκρισης παλαιότερων φαρμάκων για την αντιμετώπιση του καρκίνου του μαστού

Πίνακας 1: Παλαιότερα φάρμακα (1959 – 2000)
| Δραστική Ουσία | Έτος έγκρισης | Παρατηρήσεις |
| Cyclophosphamide (Κυκλοφωσφαμίδη) | 1959 | Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Σεπτεμβρίου 2021 του FDA, η κυκλοφωσφαμίδη είναι ένας αλκυλιωτικός παράγοντας που ενδείκνυται για τη θεραπεία μιας σειράς καρκίνων, ανάμεσα στους οποίους και του καρκίνου του μαστού. Σύμφωνα με την περίληψη των χαρακτηριστικών του προϊόντος από τον ΕΟΦ, η κυκλοφωσφαμίδη χρησιμοποιείται σε συνδυασμό με χημειοθεραπευτικά σχήματα ή ως μονοθεραπεία σε αρκετές μορφές καρκίνου, ανάμεσα στις οποίες και ο καρκίνος του μαστού. |
| Thiotepa | 1959 | To «Cancer Research» του Ηνωμένου Βασιλείου μας ενημερώνει ότι το Thiotepa είναι ένα χημειοθεραπευτικό φάρμακο που χρησιμοποιείται για τη θεραπεία πολλών διαφορετικών τύπων καρκίνου. Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Ιανουαρίου 2017 του FDA, αλλά και του «National Cancer Institute» των ΗΠΑ, το Thiotepa χορηγείται για την αντιμετώπιση του αδενοκαρκινώματος του μαστού. Πιο συγκεκριμένα, σύμφωνα με το Breastcancer.org, το φάρμακο χρησιμοποιείται μετά από χειρουργική επέμβαση και άλλες θεραπείες, για τη μείωση του κινδύνου επανεμφάνισης του πρώιμου καρκίνου του μαστού. Ο EMA, αντίστοιχα, αναφέρει, σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του 2014, ότι το Thiotepa χρησιμοποιείται σε συνδυασμό με χημειοθεραπεία με δύο τρόπους: I) ως αγωγή προετοιμασίας πριν από μεταμόσχευση αρχέγονων αιμοποιητικών κυττάρων, II) στη θεραπεία συμπαγών όγκων όταν χρειάζεται υψηλή δόση χημειοθεραπείας συνοδευόμενη από μεταμόσχευση αιμοποιητικών προγονικών κυττάρων. |
| Fluorouracil | 1962 | Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Ιουλίου 2016 του FDA, η φθοριοουρακίλη, που είναι ένας νουκλεοσιδικός μεταβολικός αναστολέας, χορηγείται σε ασθενείς που πάσχουν από αδενοκαρκίνωμα του στήθους. Ο ΕΜΑ, στις 30 Απριλίου 2020, διατύπωσε συστάσεις εισηγούμενος την εξέταση των ασθενών που πρόκειται να ξεκινήσουν αντικαρκινική θεραπεία με φθοριοουρακίλη χορηγούμενη με ένεση ή έγχυση (στάγδην χορήγηση) ή με τα συναφή φάρμακα καπεσιταβίνη και τεγαφούρη, με σκοπό τον έλεγχο τυχόν έλλειψης του ενζύμου δεϋδρογενάση της διυδροπυριμιδίνης (DPD). Σύμφωνα με την αναθεωρημένη έκδοση της 17ης Ιουλίου 2020 του electronic medicines compendium (emc) του Ηνωμένου Βασιλείου, η φθοριοουρακίλη ενδείκνυται για τη θεραπεία μιας σειράς κακοηθειών και νοσημάτων, ανάμεσα στα οποία και για τη θεραπεία του προχωρημένου ή μεταστατικού καρκίνου του μαστού, ή/και ως επικουρική θεραπεία σε ασθενείς με εγχειρήσιμο πρωτοπαθή διηθητικό καρκίνο του μαστού. |
| Doxorubicin | 1974 | Η πρώτη έγκριση του Doxorubicin στις ΗΠΑ, ενός φαρμάκου που ανήκει στην κατηγορία των ανθρακυκλινών, έγινε το 1974, ενώ ο EMA μας ενημερώνει ότι το φάρμακο έχει λάβει άδεια κυκλοφορίας από τη δεκαετία του 1960. Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Μαρτίου 2020 του FDA, συνταγογραφείται: I) μαζί με άλλα φάρμακα ως επικουρική χημειοθεραπεία για τη θεραπεία γυναικών των οποίων έχουν προσβληθεί οι μασχαλιαίοι λεμφαδένες μετά από εκτομή πρωτοπαθούς καρκίνου του μαστού, II) σε μεταστατικό καρκίνο του μαστού. Σύμφωνα με τον EMA, το «Caelyx pegylated liposomal», που περιέχει τη δραστική ουσία δοξορουβικίνη κλεισμένη μέσα σε «πεγκυλιωμένα λιποσώματα» (μικροσκοπικά λιπιδικά σωματίδια επικαλυμμένα με μια ουσία που ονομάζεται πολυαιθυλενογλυκόλη), χορηγείται για τη θεραπεία του μεταστατικού καρκίνου του μαστού σε ασθενείς που διατρέχουν κίνδυνο εμφάνισης καρδιακών προβλημάτων. Όπως μας ενημερώνει ο EMA, η συγκεκριμένη φαρμακοτεχνική μορφή του φαρμάκου μειώνει τον ρυθμό απομάκρυνσης του φαρμάκου και, ως εκ τούτου, παρατείνεται η κυκλοφορία του στο αίμα. Επίσης, η επίδρασή του φαρμάκου στους υγιείς ιστούς και τα κύτταρα είναι μικρότερη και, κατά συνέπεια, μειώνονται οι πιθανότητες πρόκλησης ανεπιθύμητων ενεργειών. |
| Vinblastine Sulfate | 1987 | Σύμφωνα με το National Cancer Institute των ΗΠΑ, η Vinblastine χορηγείται ως παρηγορητική θεραπεία-ανακουφιστική αγωγή (palliative treatment) σε ασθενείς με καρκίνο του μαστού που δεν έχει βελτιωθεί η κατάστασή τους με άλλες θεραπείες. Σύμφωνα με την αναθεωρημένη έκδοση του Δεκεμβρίου 2020, του electronic medicines compendium (emc) του Ηνωμένου Βασιλείου, η Vinblastine μπορεί να είναι χρήσιμη, είτε μόνη της είτε σε συνδυασμό με άλλα ογκολυτικά φάρμακα, για τη θεραπεία του καρκίνου του μαστού. |
| Goserelin Acetate | 1989 | Σύμφωνα με την περίληψη χαρακτηριστικών του προϊόντος από τον ΕΟΦ, το Goserelin, ως 3,6 mg ενέσιμο εμφύτευμα σε προ-γεμισμένη σύριγγα, ενδείκνυται στην αντιμετώπιση του καρκίνου του μαστού σε προ- και περι- εμμηνοπαυσιακές γυναίκες, κατάλληλες για ορμονικό χειρισμό. Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Φεβρουαρίου 2015 του FDA, το Goserelin χορηγείται ως παρηγορητική θεραπεία του προχωρημένου καρκίνου του μαστού σε προ και περι-εμμηνοπαυσιακές γυναίκες. Τέλος, σύμφωνα με την αναθεωρημένη έκδοση της 24ης Ιανουαρίου 2017, του electronic medicines compendium (emc) του Ηνωμένου Βασιλείου, το Goserelin χορηγείται για την αντιμετώπιση του προχωρημένου καρκίνου του μαστού σε προεμμηνοπαυσιακές γυναίκες κατάλληλες για ορμονικό χειρισμό. |
| Paclitaxel | 1992 | Σύμφωνα με την περίληψη χαρακτηριστικών του προϊόντος από τον ΕΟΦ, το Paclitaxel χορηγείται: I) Σε περίπτωση ανάγκης επικουρικής αντιμετώπισης, για την αγωγή ασθενών με λεμφαδενο-θετικό καρκίνωμα του μαστού μετά από θεραπεία με ανθρακυκλίνη και κυκλοφωσφαμίδη (AC). Η επικουρική θεραπεία με Paclitaxel θα πρέπει να θεωρείται εναλλακτική της εκτεταμένης θεραπείας με AC. II) Το paclitaxel ενδείκνυται για την αρχική αγωγή του τοπικά προχωρημένου ή μεταστατικού καρκίνου του μαστού, είτε σε συνδυασμό με μία ανθρακυκλίνη σε ασθενείς για τους οποίους η θεραπεία με ανθρακυκλίνη είναι κατάλληλη ή σε συνδυασμό με το trastuzumab, σε ασθενείς που υπερ-εκφράζουν τον υποδοχέα του ανθρώπινου επιδερμικού αυξητικού παράγοντα 2 (HER-2) σε 3+ επίπεδο, όπως καθορίζεται από την ανοσοϊστοχημεία και για τους οποίους δεν είναι κατάλληλη η ανθρακυκλίνη. III) Ως μοναδικός παράγοντας, στην αντιμετώπιση μεταστατικού καρκινώματος του μαστού σε ασθενείς οι οποίοι δεν ανταποκρίθηκαν επαρκώς στην τυπική αγωγή με ανθρακυκλίνες ή για τις οποίες η αγωγή με ανθρακυκλίνες δεν ήταν κατάλληλη. Σύμφωνα με το National Cancer Institute των ΗΠΑ, χορηγείται σε ασθενείς με θετική σε λεμφαδένες νόσο (node-positive disease), I) ως επικουρική θεραπεία με συνδυασμένη χημειοθεραπεία που περιέχει υδροχλωρική δοξορουβικίνη, II) σε ασθενείς με μεταστατική νόσο που δεν ανταποκρίθηκαν στη συνδυασμένη χημειοθεραπεία. |
| Pamidronate | 1992 | Σύμφωνα με τον EMA, με απόφαση της Ευρωπαϊκής Επιτροπής που εκδόθηκε στις 13 Ιουλίου 2011, αλλά και του Παραρτήματος ΙΙ με τίτλο «Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των περιλήψεων των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης», που παρουσιάστηκαν από τον ΕΜΑ, διφωσφονικά άλατα είναι φαρμακευτικά προϊόντα που χρησιμοποιούνται για τη θεραπεία και την πρόληψη οστικών διαταραχών, για την πρόληψη οστικών προβλημάτων σε ασθενείς με καρκίνο, για τη θεραπεία της οστεοπόρωσης και της νόσου του Paget. Αντίστοιχα, σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Σεπτεμβρίου 1998 του FDA, αλλά και του National Cancer Institute των ΗΠΑ, το Pamidronate Disodium έχει εγκριθεί για να χορηγείται, μαζί με χημειοθεραπεία, για τη θεραπεία της οστικής βλάβης που προκαλείται από καρκίνο του μαστού ο οποίος έχει κάνει μετάσταση στα οστά. |
| Anastrozole | 1995 | Το Anastrozole, που ανήκει στην κατηγορία των αναστολέων της αρωματάσης, εγκρίθηκε για πρώτη φορά από τον FDA το 1995: I) ως επικουρική θεραπεία του καρκίνου του μαστού σε γυναίκες μετά την εμμηνόπαυση, II) ως θεραπεία πρώτης γραμμής μετεμμηνοπαυσιακών γυναικών με άγνωστο τοπικά προχωρημένο ή μεταστατικό καρκίνο του μαστού με θετικούς ορμονικούς υποδοχείς ή ορμονικούς υποδοχείς, III) στη θεραπεία προχωρημένου καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες με εξέλιξη της νόσου, μετά από θεραπεία με Tamoxifen. Αναφέρεται ότι ασθενείς με ER-αρνητική νόσο και οι ασθενείς που δεν ανταποκρίθηκαν σε προηγούμενη θεραπεία με Tamoxifen, σπάνια ανταποκρίθηκαν στο Anastrozole. Στις 19 Μαΐου 2011, ο EMA ανακοίνωσε ότι η CHMP συμφώνησε ότι το Anastrozole πρέπει να χρησιμοποιείται στις ακόλουθες περιπτώσεις: I) Θεραπεία θετικού σε ορμονικούς υποδοχείς προχωρημένου καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες. Ο όρος «θετικός σε ορμονικούς υποδοχείς» σημαίνει ότι ο καρκίνος εξαρτάται από την παρουσία οιστρογόνων για να αναπτυχθεί. II) Ενισχυτική θεραπεία του θετικού σε ορμονικούς υποδοχείς διηθητικού καρκίνου του μαστού αρχικού σταδίου σε μετεμμηνοπαυσιακές γυναίκες, περιλαμβανομένων όσων έχουν λάβει ενισχυτική θεραπεία με Tamoxifen για δύο ή τρία έτη. |
| Toremifene | 1996 | Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Μαΐου 2017 του FDA, το Toremifene, που είναι ένας ανταγωνιστής των οιστρογόνων (αντι-οιστρογόνο), ενδείκνυται για τη θεραπεία του μεταστατικού καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες με θετικούς ή άγνωστους όγκους σε υποδοχείς οιστρογόνων. Σύμφωνα με την Ευρωπαϊκή Δημόσια Έκθεση Αξιολόγησης (EPAR) του EMA, το Toremifene χρησιμοποιείται για τη θεραπεία του ορμονοεξαρτώμενου μεταστατικού καρκίνου του μαστού σε γυναίκες μετά την εμμηνόπαυση. Ο όρος «μεταστατικός» σημαίνει ότι ο καρκίνος έχει εξαπλωθεί σε άλλα μέρη του σώματος. Δεν συνιστάται η χορήγηση του Toremifene σε ασθενείς με όγκους αρνητικούς για υποδοχείς οιστρογόνων (καρκινικά κύτταρα που δεν διαθέτουν υποδοχείς οιστρογόνου στην επιφάνειά τους). |
| Gemcitabine HCL | 1996 | Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Ιουνίου 2019 του FDA, το ενέσιμο Gemcitabine είναι ένας νουκλεοσιδικός μεταβολικός αναστολέας που ενδείκνυται σε συνδυασμό με Paclitaxel, για θεραπεία πρώτης γραμμής του μεταστατικού καρκίνου του μαστού μετά από αποτυχία προηγούμενης επικουρικής χημειοθεραπείας που περιέχει ανθρακυκλίνη ή σε περίπτωση που οι ανθρακυκλίνες αντενδείκνυνται κλινικά. Σύμφωνα με την περίληψη χαρακτηριστικών του προϊόντος από τον ΕΟΦ, η Gemcitabine, που είναι εγκεκριμένη με αμοιβαία ή αποκεντρωμένη διαδικασία, ενδείκνυται σε συνδυασμό με Paclitaxel, για τη θεραπεία ασθενών με τοπικά υποτροπιάζοντα ή μεταστατικό καρκίνο μαστού ο οποίος δεν δύναται να υποβληθεί σε εκτομή και παρουσίασε υποτροπή μετά από επικουρική/νεο-επικουρική χημειοθεραπεία. Στην προηγούμενη χημειοθεραπεία θα πρέπει να είχε συμπεριληφθεί ανθρακυκλίνη, εκτός εάν υπάρχει κλινική αντένδειξη. |
| Letrozole | 1997 | Ο EMA μας ενημερώνει, σύμφωνα με την επανεξέταση του φαρμάκου που έγινε στις 15 Μαρτίου 2012, πως το Letrozole, που είναι ένας «αναστολέας αρωματάσης», δηλαδή δρα αναστέλλοντας τη δράση του ενζύμου «αρωματάση» το οποίο μετέχει στην παραγωγή οιστρογόνων, πρέπει να χρησιμοποιείται σε μετεμμηνοπαυσιακές γυναίκες στις ακόλουθες περιπτώσεις: I) Επικουρική (μετεγχειρητική) θεραπεία του θετικού σε ορμονικούς υποδοχείς διηθητικού καρκίνου του μαστού αρχικού σταδίου. II) Παρατεταμένη επικουρική θεραπεία ορμονοεξαρτώμενου διηθητικού καρκίνου του μαστού σε γυναίκες οι οποίες έχουν λάβει προηγούμενη βασική επικουρική θεραπεία με ταμοξιφαίνη επί 5 χρόνια. III) Θεραπεία πρώτης γραμμής του ορμονοεξαρτώμενου προχωρημένου καρκίνου του μαστού. IV) Προχωρημένος καρκίνος μαστού μετά από υποτροπή ή εξέλιξη της νόσου, σε γυναίκες που έχουν μεταβεί φυσιολογικά ή τεχνητά σε μετεμμηνοπαυσιακή ενδοκρινική κατάσταση και έχουν στο παρελθόν υποβληθεί σε αντι-οιστρογονική θεραπεία. V) Νέο-επικουρική (προεγχειρητική) θεραπεία καρκίνου του μαστού αρνητικού στον HER-2 (ανθρώπινος υποδοχέας του επιδερμικού αυξητικού παράγοντα 2) με θετικούς ορμονικούς υποδοχείς σε γυναίκες οι οποίες δεν είναι επιδεκτικές σε χημειοθεραπεία και για τις οποίες δεν ενδείκνυται άμεση χειρουργική επέμβαση. Αντίστοιχα, στις αναθεωρημένες οδηγίες συνταγογράφησης του Απριλίου 2018 του FDA, το Letrozole ενδείκνυται: I) ως επικουρική θεραπεία μετεμμηνοπαυσιακών γυναικών με πρώιμο καρκίνο του μαστού θετικούς σε ορμονικούς υποδοχείς, II) ως εκτεταμένη επικουρική θεραπεία μετεμμηνοπαυσιακών γυναικών με πρώιμο καρκίνο του μαστού που έχουν λάβει προηγούμενη καθιερωμένη επικουρική θεραπεία με ταμοξιφαίνη και III) ως θεραπεία πρώτης και δεύτερης γραμμής μετεμμηνοπαυσιακών γυναικών θετικών σε ορμονικούς υποδοχείς ή άγνωστο προχωρημένο καρκίνο του μαστού. |
| Raloxifene Hydrochloride | 1997 | Η Raloxifene είναι ένας εκλεκτικός ρυθμιστής των οιστρογονικών υποδοχέων (SERM). Η Raloxifene, σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Ιουνίου 2018 του FDA, χορηγείται για: I) τη μείωση του κινδύνου του διηθητικού καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες με οστεοπόρωση, II) τη μείωση του κινδύνου διηθητικού καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες που παρουσιάζουν υψηλό κίνδυνο για διηθητικό καρκίνο του μαστού. |
| Capecitabine | 1998 | Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Μαΐου 2021 του FDA, το Capecitabine χορηγείται στον μεταστατικό καρκίνο του μαστού σε συνδυασμό με Docetaxel μετά από αποτυχία προηγούμενης θεραπείας με φάρμακο της κατηγορίας των ανθρακυκλινών, αλλά και ως μονοθεραπεία σε ασθενείς που είναι ανθεκτικοί τόσο στην Paclitaxel, όσο και σε θεραπευτικά σχήματα που περιέχουν φάρμακα της κατηγορίας των ανθρακυκλινών. Σύμφωνα με την Ευρωπαϊκή Δημόσια Έκθεση Αξιολόγησης (EPAR) του EMA του 2020, το Capecitabine είναι φάρμακο το οποίο χρησιμοποιείται στη θεραπεία του τοπικά προχωρημένου ή μεταστατικού καρκίνου του μαστού (καρκίνος του μαστού που έχει αρχίσει να εξαπλώνεται σε άλλα μέρη του σώματος). Το Capecitabine χορηγείται σε συνδυασμό με Docetaxel όταν η θεραπεία με ανθρακυκλίνες δεν έχει φέρει αποτέλεσμα. Μπορεί επίσης να χρησιμοποιηθεί ως μονοθεραπεία όταν η θεραπεία τόσο με ανθρακυκλίνες όσο και με ταξάνες έχει αποτύχει ή σε περιπτώσεις όπου δεν ενδείκνυται για τον ασθενή η περαιτέρω θεραπεία με ανθρακυκλίνες. |
| Trastuzumab | 1998 | Σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR), το Trastuzumab χρησιμοποιείται μόνο όταν έχει αποδειχτεί ότι ο καρκίνος εμφανίζει «υπερέκφραση της HER2»: αυτό σημαίνει ότι ο καρκίνος παράγει μια συγκεκριμένη πρωτεΐνη που ονομάζεται HER2 σε μεγάλες ποσότητες στην επιφάνεια των κυττάρων του όγκου, επιτυγχάνοντας έτσι την ανάπτυξη των καρκινικών κυττάρων. Σε αυτή την περίπτωση, το Trastuzumab χορηγείται για τη θεραπεία των ακόλουθων μορφών καρκίνου: I) Πρώιμο καρκίνο του μαστού (όταν ο καρκίνος έχει εξαπλωθεί στον μαστό ή στους αδένες κάτω από τη μασχάλη αλλά όχι σε άλλα μέρη του σώματος) μετά από χειρουργική επέμβαση, χημειοθεραπεία και ακτινοθεραπεία, ανάλογα με την περίπτωση. Μπορεί επίσης να χορηγηθεί σε πρώιμο στάδιο της θεραπείας σε συνδυασμό με χημειοθεραπεία. Για τους τοπικά προχωρημένους όγκους (περιλαμβανομένων των φλεγμονωδών όγκων) ή για όσους είναι μεγαλύτεροι από 2 εκατοστά, το Trastuzumab χορηγείται πριν από τη χειρουργική επέμβαση σε συνδυασμό με χημειοθεραπεία και, στη συνέχεια, χορηγείται εκ νέου μετά την επέμβαση ως μονοθεραπεία. II) Μεταστατικό καρκίνο του μαστού. Χορηγείται ως μονοθεραπεία σε ασθενείς που δεν ανταποκρίθηκαν σε προηγούμενες θεραπείες. Χορηγείται επίσης σε συνδυασμό με άλλα αντικαρκινικά φάρμακα: με την Paclitaxel ή τη Docetaxel ή με αναστολέα της αρωματάσης. Αντίστοιχα, ο FDA, τον Σεπτέμβριο του 1998, ενέκρινε το Trastuzumab για τη θεραπεία του μεταστατικού καρκίνου του μαστού. Τον Νοέμβριο του 2016, ο FDA ενέκρινε το φάρμακο ως μέρος του θεραπευτικού σχήματος που συμπεριλαμβάνει Doxorubicin, Cyclophosphamide, και Paclitaxel ως επικουρική θεραπεία του HER2-θετικού καρκίνου του μαστού. Η επικουρική θεραπεία, σύμφωνα με τον FDA, χορηγείται σε γυναίκες με καρκίνο του μαστού σε πρώιμο στάδιο (τοπικό) που έχουν ήδη χειρουργηθεί ή έχουν υποστεί ακτινοθεραπεία, με στόχο να μειώσουν τον κίνδυνο επανεμφάνισης του καρκίνου ή μετάστασής του σε άλλα μέρη του σώματος. |
| Epirubicin | 1999 | Σύμφωνα με την Περίληψη των Χαρακτηριστικών του Προϊόντος που έχει εκδώσει ο ΕΟΦ, η Epirubicin, που είναι ένας αντιμιτωτικός κυτταροστατικός παράγοντας (ανήκει στην κατηγορία των ανθρακυκλινών), χορηγούμενη μόνη της σε χημειοθεραπευτικά σχήματα προκαλεί ύφεση σε ένα ευρύ φάσμα καρκίνων, ανάμεσα στους οποίους περιλαμβάνεται και ο καρκίνος του μαστού. Συγκεκριμένα, χορηγείται ως επικουρική θεραπεία σε ασθενείς με καρκίνο μαστού με θετικούς λεμφαδένες ο οποίος βρίσκεται σε πρώιμο στάδιο. Σύμφωνα με τις αναθεωρημένες οδηγίες συνταγογράφησης του Ιουλίου 2019 του FDA, ενδείκνυται ως συστατικό της επικουρικής θεραπείας σε ασθενείς με ενδείξεις διήθησης μασχαλιαίου λεμφαδένα από τον όγκο (axillary node tumor involvement), μετά από εκτομή πρωτοπαθούς καρκίνου του μαστού. |
| Exemestane | 1999 | Σύμφωνα με την Περίληψη των Χαρακτηριστικών του Προϊόντος του ΕΟΦ, το Exemestane ενδείκνυται: I) για την επικουρική θεραπεία σε μετεμμηνοπαυσιακές γυναίκες με διηθητικό πρώιμο καρκίνο του μαστού (ΠΚΜ) και θετικούς οιστρογονικούς υποδοχείς, ως διαδοχική θεραπεία μετά από τουλάχιστον 2-3 έτη αρχικής επικουρικής αγωγής με ταμοξιφαίνη. II) Για τη θεραπεία του προχωρημένου καρκίνου του μαστού σε γυναίκες με φυσική ή προκληθείσα εμμηνόπαυση, η νόσος των οποίων έχει επιδεινωθεί μετά από αντιοιστρογονική θεραπεία. Η αποτελεσματικότητα δεν έχει τεκμηριωθεί σε ασθενείς των οποίων ο καρκίνος δεν έχει υποδοχείς οιστρογόνων. Αντίστοιχα, ο FDA ενέκρινε το Exemestane: I) ως επικουρική θεραπεία, για τον πρώιμο καρκίνο του μαστού σε μετεμμηνοπαυσιακές γυναίκες και θετικούς οιστρογονικούς υποδοχείς που έχουν λάβει θεραπεία για 2-3 έτη με tamoxifen, II) για τη θεραπεία του προχωρημένου καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες των οποίων η νόσος έχει εξελιχθεί, μετά από θεραπεία με Tamoxifen. Τέλος, το electronic medicines compendium (emc) του Ηνωμένου Βασιλείου αναφέρει ότι το Exemestane ενδείκνυται ως επικουρική θεραπεία του πρώιμου διηθητικού καρκίνου του μαστού σε γυναίκες με θετικούς οιστρογονικούς υποδοχείς, οι οποίες έχουν λάβει προηγουμένως για 2-3 χρόνια επικουρική θεραπεία με Tamoxifen. Επίσης, σύμφωνα πάντα με το emc, το φάρμακο ενδείκνυται για θεραπεία του προχωρημένου καρκίνου του μαστού σε γυναίκες με φυσική ή προκληθείσα εμμηνόπαυση των οποίων ο καρκίνος έχει εξελιχθεί μετά από αντι-οιστρογονική θεραπεία. Η δραστικότητα του φαρμάκου δεν έχει αποδειχθεί σε ασθενείς αρνητικούς σε υποδοχείς οιστρογόνων. |
Σχεδιάγραμμα 2: Χρονολογική σειρά έγκρισης νεότερων φαρμάκων για την αντιμετώπιση του καρκίνου του μαστού
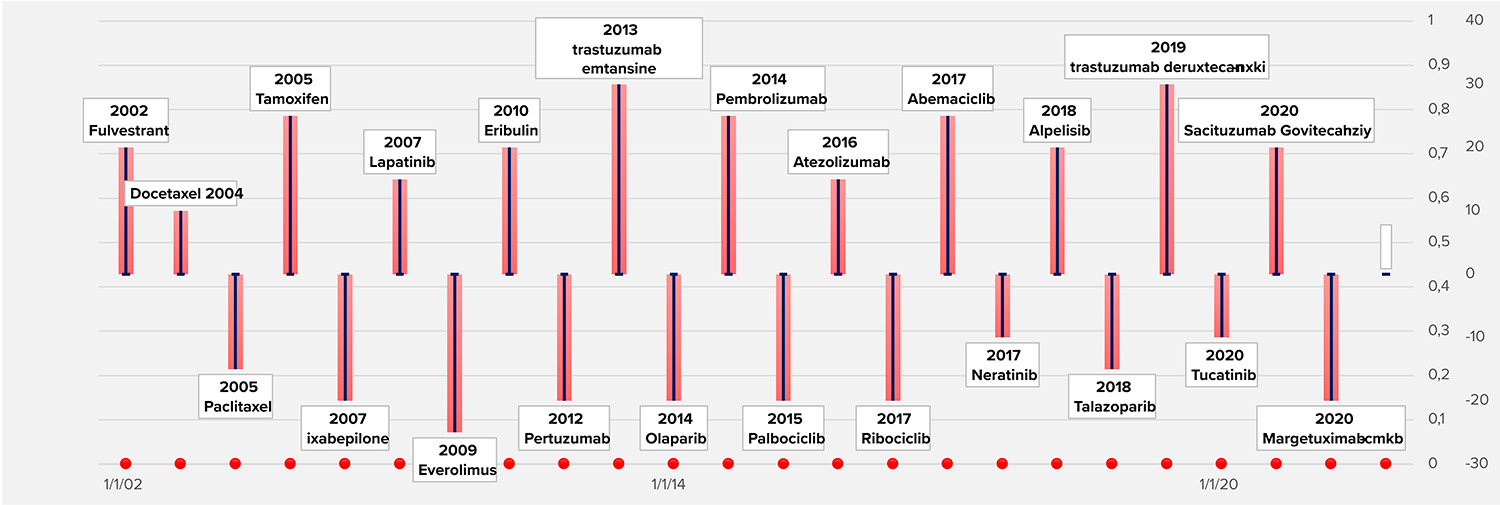
Πίνακας 2: Νεότερα φάρμακα για την αντιμετώπιση του καρκίνου του μαστού (2001 – 2021)
| Δραστική ουσία | Έτος 1ης έγκρισης | Παρατηρήσεις |
| Fulvestrant | 2002 | Σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR), το Fulvestrant είναι ένα αντι-οιστρογόνο φάρμακο που χρησιμοποιείται για τη θεραπεία του προχωρημένου ή μεταστατικού καρκίνου του μαστού στις παρακάτω ασθενείς: I) Μετεμμηνοπαυσιακές γυναίκες με έναν τύπο καρκίνου του μαστού γνωστό ως «καρκίνος θετικός για υποδοχείς οιστρογόνων», οι οποίες δεν έχουν λάβει στο παρελθόν ορμονική θεραπεία ή των οποίων ο καρκίνος έχει παρουσιάσει υποτροπή έπειτα από θεραπεία με κάποιο άλλο αντι-οιστρογόνο φάρμακο. II) Γυναίκες με έναν τύπο καρκίνου του μαστού γνωστό ως «καρκίνος θετικός για ορμονικούς υποδοχείς (HR) και αρνητικός για τον υποδοχέα HER-2» οι οποίες έχουν λάβει στο παρελθόν ορμονική θεραπεία. Στις γυναίκες που πάσχουν από αυτόν τον τύπο καρκίνου του μαστού, το Fulvestrant χορηγείται σε συνδυασμό με παλμποσικλίμπη. Αντίστοιχα, ο FDA, στην αρχική του έγκριση, ενέκρινε το Fulvestrant για τη θεραπεία του μεταστατικού καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες με εξέλιξη της νόσου μετά από θεραπεία με αντιοιστρογόνα, όπως η ταμοξιφαίνη, των οποίων ο καρκίνος είναι θετικός στους ορμονικούς υποδοχείς. Στις 13 Σεπτεμβρίου 2010, ο FDA ενέκρινε τη δόση των 500 mg του Fulvestrant, αντικαθιστώντας την προηγουμένως εγκεκριμένη μηνιαία δόση των 250 mg, για τη θεραπεία του θετικού σε ορμονικούς υποδοχείς μεταστατικού καρκίνου του μαστού σε μετεμμηνοπαυσιακές γυναίκες με εξέλιξη της νόσου μετά από θεραπεία με αντι-οιστρογόνα. Στις 28 Αυγούστου του 2017, ο FDA ενέκρινε το Fulvestrant 500 mg ως μονοθεραπεία για εκτεταμένη χρήση σε μετεμμηνοπαυσιακές γυναίκες με προχωρημένο καρκίνο του μαστού θετικό σε ορμονικούς υποδοχείς (HR+), αρνητικό για τον υποδοχέα HER2, που δεν έχουν λάβει προηγούμενη ορμονική θεραπεία. Τέλος, ο ίδιος οργανισμός, στις 15 Νοεμβρίου 2017, ενέκρινε μια νέα ένδειξη για το Fulvestrant, επεκτείνοντας τις ενδείξεις για να συμπεριλάβει τη χρήση με Abemaciclib, έναν αναστολέα CDK4/6 για τη θεραπεία προηγμένων θετικών στους ορμονικούς υποδοχείς (HR+), αρνητικών στον υποδοχέα HER2, ή σε μεταστατικό καρκίνο του μαστού σε γυναίκες με εξέλιξη της νόσου μετά από ορμονική θεραπεία. |
| Docetaxel | 2004 | Σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR), το Docetaxel είναι ένα αντικαρκινικό φάρμακο το οποίο χρησιμοποιείται για τη θεραπεία διαφόρων μορφών καρκίνου, ανάμεσα στους οποίους και ο καρκίνος του μαστού. Συγκεκριμένα, το Docetaxel μπορεί να χορηγείται ως μονοθεραπεία κατόπιν αποτυχίας άλλων θεραπειών. Μπορεί, επίσης, να χορηγείται σε συνδυασμό με άλλα αντικαρκινικά φάρμακα (δοξορουβικίνη , κυκλοφωσφαμίδη, trastuzumab ή καπεσιταβίνη), σε ασθενείς οι οποίοι δεν έχουν υποβληθεί ακόμη σε θεραπεία κατά του καρκίνου ή κατόπιν αποτυχίας άλλων θεραπειών, ανάλογα με τον τύπο και το στάδιο του καρκίνου του μαστού. Αντίστοιχα, ο FDA έχει εγκρίνει το φάρμακο για τον τοπικά προχωρημένο ή για τον μεταστατικό καρκίνο του μαστού. |
| Paclitaxel Albumin | 2005 | Το Paclitaxel Albumin περιέχει τη δραστική ουσία πακλιταξέλη, η οποία είναι προσκολλημένη σε μια ανθρώπινη πρωτεΐνη που ονομάζεται λευκωματίνη. Το γεγονός αυτό διευκολύνει την παρασκευή εναιωρήματος πακλιταξέλης για ενδοφλέβια έγχυση. Σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR), το Paclitaxel Albumin χορηγείται για τη θεραπεία του μεταστατικού καρκίνου του μαστού, όταν η πρώτη θεραπεία έπαψε να είναι αποτελεσματική και η συνήθης θεραπεία, που περιέχει «ανθρακυκλίνη», κρίνεται ακατάλληλη. Αντίστοιχα, ο FDA έχει εγκρίνει το Paclitaxel Albumin για τον μεταστατικό καρκίνο του μαστού, μετά από αποτυχία συνδυαστικής χημειοθεραπείας ή μετά από υποτροπή της νόσου εντός 6 μηνών από την επικουρική χημειοθεραπεία. Η προηγούμενη θεραπεία θα πρέπει να περιλάμβανε ανθρακυκλίνη, εκτός εάν υπάρχει κλινική αντένδειξη γι’ αυτή την επιλογή. |
| Tamoxifen Citrate | 2005 | Σύμφωνα με την Περίληψη των Χαρακτηριστικών του Προϊόντος του ΕΟΦ, το Tamoxifen Citrate ενδείκνυται ως συμπληρωματική θεραπεία αρχικών σταδίων καρκίνου του μαστού και ως ανακουφιστική θεραπεία μεταστατικού καρκίνου του μαστού στις γυναίκες. Αποτελεί φάρμακο εκλογής σε γυναίκες μετά την εμμηνόπαυση, όπου τα 2/3 των περιπτώσεων καρκίνου είναι θετικά σε οιστρογονικούς υποδοχείς. Ευνοϊκή ανταπόκριση παρατηρείται σε ποσοστό 20-30% του συνόλου των γυναικών με μεταστατικό καρκίνο του μαστού, ενώ φθάνει το 60% σε γυναίκες με θετικούς οιστρογονικούς υποδοχείς. Αντίθετα, σε γυναίκες στις οποίες δεν ανιχνεύονται οιστρογονικοί υποδοχείς, το ποσοστό ευνοϊκής ανταπόκρισης είναι κάτω του 10%. Προηγούμενη ανταπόκριση σε ορμονοθεραπεία προδικάζει και ευνοϊκή ανταπόκριση στην ταμοξιφαίνη. Αντίστοιχα, ο FDA έχει εγκρίνει το Tamoxifen Citrate για την επικουρική θεραπεία του καρκίνου του μαστού και του μεταστατικού καρκίνου του μαστού, καθώς και για τη μείωση του κινδύνου καρκίνου του μαστού σε γυναίκες με DCIS ή για τη μείωση της συχνότητας εμφάνισης καρκίνου του μαστού σε γυναίκες που παρουσιάζουν υψηλό κίνδυνο εμφάνισης του καρκίνου του μαστού. |
| Ixabepilone | 2007 | Όπως μας ενημερώνει ο EMA, ο ΚΑΚ του φαρμάκου, στις 18 Μαρτίου 2009, κοινοποίησε επίσημα στην Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) την πρόθεσή του να αποσύρει την αίτηση χορήγησης άδειας κυκλοφορίας στο σκεύασμα για τη θεραπεία του τοπικά προχωρημένου ή μεταστατικού καρκίνου του μαστού. Το φάρμακο επρόκειτο να χρησιμοποιηθεί για τη θεραπεία του τοπικά προχωρημένου ή μεταστατικού καρκίνου του μαστού. Ο FDA χορήγησε, τον Οκτώβριο του 2007, άδεια έγκρισης του Ixabepilone ως μονοθεραπείας για σε ασθενείς με μεταστατικό ή τοπικά προχωρημένο καρκίνο του μαστού σε ασθενείς των οποίων οι όγκοι είναι ανθεκτικοί ή ανθεκτικοί στις ανθρακυκλίνες, τις ταξάνες και την καπεσιταβίνη. |
| Lapatinib | 2007 | Σύμφωνα με την Ανασκόπηση του EMA του 2018, το Lapatinib είναι φάρμακο κατά του καρκίνου που χρησιμοποιείται για τη θεραπεία ασθενών με καρκίνο του μαστού ο οποίος έχει καταδειχθεί ότι εμφανίζει υπερέκφραση της HER2. Το Lapatinib χορηγείται ως εξής: I) Σε συνδυασμό με καπεσιταμπίνη σε ασθενείς με προχωρημένο ή μεταστατικό καρκίνο οι οποίοι παρουσίασαν επιδείνωση της νόσου μετά από προηγούμενη θεραπεία που περιελάμβανε ανθρακυκλίνες και ταξάνες και κατόπιν θεραπείας της μεταστατικής νόσου του ασθενούς με Trastuzumab. II) Σε συνδυασμό με Trastuzumab για μεταστατικό καρκίνο που δεν ανταποκρίνεται στις ορμόνες (νόσος αρνητική σε ορμονικό υποδοχέα) και επιδεινώθηκε κατόπιν της θεραπείας με συνδυασμό Trastuzumabς και άλλων αντικαρκινικών φαρμάκων (χημειοθεραπεία). III) Σε συνδυασμό με αναστολέα της αρωματάσης σε γυναίκες που έχουν περάσει την εμμηνόπαυση, όταν ο καρκίνος είναι μεταστατικός και ανταποκρίνεται στις ορμόνες. Ο εν λόγω συνδυασμός χρησιμοποιείται σε γυναίκες που δεν έχουν επί του παρόντος ανάγκη να υποβληθούν στη συνήθη χημειοθεραπεία για τη θεραπεία του καρκίνου τους. Αντίστοιχα, ο FDA ενέκρινε το Lapatinib, σε συνδυασμό με Capecitabine για τη θεραπεία ασθενών με προχωρημένο ή μεταστατικό καρκίνο του μαστού των οποίων οι όγκοι υπερεκφράζουν το HER2 και οι οποίοι έχουν λάβει προηγούμενη θεραπεία που περιλαμβάνει ανθρακυκλίνη, ταξάνη και Trastuzumab. Τον Φεβρουάριο του 2010, ο FDA χορήγησε ταχεία έγκριση για ένα νέο συνδυαστικό θεραπευτικό σχήμα που χρησιμοποιεί το Lapatinib ως θεραπεία πρώτης γραμμής, αποκλειστικά από του στόματος για γυναίκες με μεταστατικό καρκίνο του μαστού. Το Lapatinib ενδείκνυται πλέον σε συνδυασμό με Letrozole για τη θεραπεία μετεμμηνοπαυσιακών γυναικών με μεταστατικό καρκίνο του μαστού θετικό σε ορμονικούς υποδοχείς που υπερεκφράζει τον υποδοχέα HER2 για τους οποίους ενδείκνυται ορμονική θεραπεία. |
| Everolimus | 2009 | Σύμφωνα με την ανασκόπηση του φαρμάκου το 2018 και το αιτιολογικό της έγκρισης στην Ε.Ε., το Everolimus είναι αντικαρκινικό φάρμακο το οποίο χρησιμοποιείται για τη θεραπεία διαφόρων μορφών καρκίνου, ανάμεσα στους οποίους και για τον προχωρημένο καρκίνο του μαστού σε μετεμμηνοπαυσιακές γυναίκες. Το Everolimus χρησιμοποιείται για τη θεραπεία του καρκίνου του μαστού που είναι «θετικός σε ορμονικούς υποδοχείς» (όταν τα καρκινικά κύτταρα διαθέτουν υποδοχείς οιστρογόνων στην επιφάνειά τους) και «HER2/neu αρνητικός» (όταν τα καρκινικά κύτταρα δεν περιέχουν υψηλά επίπεδα της πρωτεΐνης HER2/neu. Το Everolimus χορηγείται σε συνδυασμό με ένα άλλο φάρμακο, την εξεμεστάνη, εφόσον άλλες θεραπείες με μη στεροειδείς αναστολείς αρωματάσης έχουν αποτύχει. Τον Ιούλιο του 2012, ο FDA των ΗΠΑ ενέκρινε το Everolimus για τη θεραπεία ορισμένων μετεμμηνοπαυσιακών γυναικών με προχωρημένο καρκίνο του μαστού θετικό σε ορμονικούς υποδοχείς, αρνητικό HER2, σε συνδυασμό με Exemestane. Ο συνδυασμός του φαρμάκου με Exemestane ενδείκνυται για χορήγηση σε γυναίκες που έχουν υποτροπιάσει ή σε γυναίκες με εξέλιξη του καρκίνου τους μετά από θεραπεία με λετροζόλη ή αναστροζόλη. |
| Eribulin Mesylate | 2010 | Σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του 2016, το Eribulin Mesylate χρησιμοποιείται για τη θεραπεία τοπικά προχωρημένου ή μεταστατικού καρκίνου του μαστού που συνεχίζει να εξαπλώνεται αφού έχει προηγηθεί τουλάχιστον άλλη μία θεραπεία για προχωρημένο καρκίνο με φάρμακα της κατηγορίας των ανθρακυκλινών και ταξανών, εκτός εάν τέτοιου είδους θεραπεία δεν είχε κριθεί κατάλληλη. Αντίστοιχα, ο FDA των ΗΠΑ ενέκρινε το Eribulin Mesylate για τη θεραπεία ασθενών με μεταστατικό καρκίνο του μαστού που έχουν λάβει τουλάχιστον δύο προηγούμενα χημειοθεραπευτικά σχήματα για τη νόσο τελικού σταδίου. |
| Pertuzumab | 2012 | Σύμφωνα με την ανασκόπηση και το αιτιολογικό έγκρισης του φαρμάκου στην Ε.Ε. το 2018, το Pertuzumab είναι αντικαρκινικό φάρμακο για τη θεραπεία ενηλίκων που πάσχουν από καρκίνο του μαστού θετικό στην πρωτεΐνη HER2. Το φάρμακο χρησιμοποιείται στις ακόλουθες περιπτώσεις: I) για τη θεραπεία του μεταστατικού καρκίνου του μαστού σε ασθενείς που δεν έχουν λάβει προηγούμενη θεραπεία με χημειοθεραπευτικά φάρμακα ή φάρμακα ειδικά στοχευμένα στην HER2, ή για τη θεραπεία του καρκίνου του μαστού που έχει επανεμφανιστεί τοπικά μετά από θεραπεία και δεν μπορεί να αφαιρεθεί χειρουργικά. Σε αυτές τις περιπτώσεις, το Pertuzumab χρησιμοποιείται μαζί με Trastuzumab και Docetaxel, II) για τη θεραπεία του τοπικά προχωρημένου, φλεγμονώδους ή πρώιμου σταδίου καρκίνου του μαστού με υψηλό κίνδυνο υποτροπής, σε συνδυασμό με Trastuzumab και χημειοθεραπεία, πριν από τη χειρουργική επέμβαση, III) για τη θεραπεία του πρώιμου καρκίνου του μαστού με υψηλό κίνδυνο υποτροπής, σε συνδυασμό με Trastuzumab και χημειοθεραπεία, μετά από χειρουργική επέμβαση. Αντίστοιχα, ο FDA, τον Ιούνιο του 212 ενέκρινε το Pertuzumab, σε συνδυασμό με χημειοθεραπεία (Trastuzumab) και Docetaxel, για τη θεραπεία ατόμων με HER2 θετικό μεταστατικό καρκίνο του μαστού που δεν έχουν λάβει προηγούμενη θεραπεία anti-HER2 ή χημειοθεραπεία για μεταστατική νόσο. Τον Σεπτέμβριο του 2013, ο FDA χορήγησε ταχεία έγκριση στο Pertuzumab ως μέρος ενός πλήρους θεραπευτικού σχήματος για ασθενείς με πρώιμο στάδιο καρκίνου του μαστού, πριν από τη χειρουργική επέμβαση (νέο-επικουρική θεραπεία). Τέλος, τον Δεκέμβριο του 2017, ο FDA ενέκρινε το Pertuzumab, σε συνδυασμό με Trastuzumab και χημειοθεραπεία, για επικουρική (μετά τη χειρουργική επέμβαση) θεραπεία του HER2-θετικού πρώιμου καρκίνου του μαστού που παρουσιάζει υψηλό κίνδυνο υποτροπής . |
| Trastuzumab Emtansine | 2013 | Σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του Trastuzumab Emtansine, η δραστική ουσία του φαρμάκου αποτελείται από δύο δραστικά συστατικά που συνδέονται μεταξύ τους: α) την Trastuzumab, που είναι μονοκλωνικό αντίσωμα το οποίο έχει σχεδιαστεί ώστε να αναγνωρίζει και να προσκολλάται στην πρωτεΐνη HER2, η οποία βρίσκεται σε μεγάλες ποσότητες στην επιφάνεια ορισμένων καρκινικών κυττάρων και β) την Emtansine, που αναφέρεται στο σύμπλεγμα MCC-DM1. Κατά μέσο όρο, 3,5 μόρια DM1 συζευγνύονται σε κάθε μόριο Trastuzumab. Η σύζευξη του DM1 στην Trastuzumab συνεπάγεται την εκλεκτικότητα του κυτταροτοξικού παράγοντα για τα καρκινικά κύτταρα που υπερεκφράζουν τον HER2, αυξάνοντας κατά συνέπεια την ενδοκυττάρια παροχή DM1 απευθείας στα κακοήθη κύτταρα. To Trastuzumab Emtansine χορηγείται για τη θεραπεία του προχωρημένου ή μεταστατικού καρκίνου του μαστού σε ενήλικες οι οποίοι έχουν λάβει προηγουμένως Trastuzumab και κάποια ταξάνη. Αντίστοιχα, ο FDA ενέκρινε τον Φεβρουάριο του 2013 το Ado-Trastuzumab Emtansine για ασθενείς με HER2 θετικό, που βρίσκονται στο τελευταίο στάδιο (μεταστατικό) καρκίνου του μαστού. Το φάρμακο χορηγείται σε ασθενείς που είχαν λάβει προηγουμένως θεραπεία με Trastuzumab και ταξάνες. Τον Μάιο του 2019, ο FDA ενέκρινε το Ado-Trastuzumab Emtansine για επικουρική θεραπεία (μετά από χειρουργική επέμβαση) ατόμων με πρώιμο καρκίνο του μαστού θετικού HER2 που έχουν υπολειπόμενη διηθητική νόσο μετά από θεραπεία με νεοεπικουρική (πριν από την επέμβαση) ταξάνη και Trastuzumab. |
| Olaparib | 2014 | Σύμφωνα με τη σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR), το Olaparib είναι ένα αντικαρκινικό φάρμακο το οποίο χρησιμοποιείται για μια σειρά καρκίνων, ανάμεσα στους οποίους τον HER2-αρνητικό καρκίνο του μαστού ο οποίος έχει εξαπλωθεί πέρα από την αρχική εστία σε ασθενείς με μεταλλάξεις στο γονίδιο BRCA1 ή στο γονίδιο BRCA2. Οι ασθενείς έχουν λάβει ορισμένα φάρμακα κατά του καρκίνου του μαστού, τα οποία σταμάτησαν να είναι αποτελεσματικά ή δεν ήταν κατάλληλα. Αντίστοιχα, ο FDA ενέκρινε τον Ιούνιο του 2017 το Olaparib σε ασθενείς με μεταστατικό καρκίνο του μαστού με μεταλλαγμένο το γονίδιο BRCA. Το φάρμακο έδειξε να μειώνει σημαντικά τον κίνδυνο επιδείνωσης της νόσου ή θανάτου. Τον Ιανουάριο του 2018, ο FDA επέκτεινε τη χρήση του Olaparib, για να συμπεριλάβει τη θεραπεία ασθενών με ορισμένους τύπους καρκίνου του μαστού που έχουν εξαπλωθεί (μεταστάσεις) και των οποίων οι όγκοι έχουν μια συγκεκριμένη κληρονομική γενετική μετάλλαξη (βλαστική σειρά), καθιστώντας το το πρώτο φάρμακο στην κατηγορία του (αναστολέας PARP) που έχει εγκριθεί για τη θεραπεία του καρκίνου του μαστού ορισμένων ασθενών με μεταστατικό καρκίνο του μαστού που έχουν γονιδιακή μετάλλαξη BRCA. Τέλος, τον Μάρτιο του 2022, ο FDA ενέκρινε το Olaparib για την επικουρική θεραπεία ασθενών με πρώιμο καρκίνο του μαστού υψηλού κινδύνου HER2 αρνητικό σε μεταλλαγμένο BRCA (gBRCAm) που έχουν ήδη υποβληθεί σε χημειοθεραπεία είτε πριν είτε μετά την επέμβαση. |
| Pembrolizumab | 2014 | Σύμφωνα με την Ανασκόπηση του 2022 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε. για το Pembrolizumab, το φάρμακο χρησιμοποιείται για τη θεραπεία διαφόρων μορφών καρκίνου, ανάμεσα στους οποίους και ο «τριπλά αρνητικός καρκίνος του μαστού». Σύμφωνα με την κύρια μελέτη του Pembrolizumab, που το συνέκρινε, σε συνδυασμό με χημειοθεραπεία, με εικονικό φάρμακο και χημειοθεραπεία σε 847 ασθενείς με πρωτοθεραπευόμενο τριπλό αρνητικό καρκίνο του μαστού, ο οποίος δεν μπορούσε να αφαιρεθεί χειρουργικά ή είχε εξαπλωθεί, οι ασθενείς με υψηλά επίπεδα έκφρασης PD-L1 που έλαβαν το φάρμακο, έζησαν περίπου 10 μήνες χωρίς επιδείνωση της νόσου, ενώ οι ασθενείς στην ομάδα του εικονικού φαρμάκου έζησαν για 5 μήνες χωρίς επιδείνωση της νόσου. Όταν εξετάστηκε κατά τη μελέτη η επιβίωση, η ομάδα που έλαβε Pembrolizumab έζησε για μεγαλύτερο χρονικό διάστημα: 23 μήνες σε σύγκριση με 16 μήνες. Αντίστοιχα, τον Νοέμβριο του 2020, ο FDA ενέκρινε το Pembrolizumab, σε συνδυασμό με χημειοθεραπεία, για τη θεραπεία ασθενών με τοπικά υποτροπιάζοντα ανεγχείρητο ή μεταστατικό τριπλά αρνητικό καρκίνο του μαστού (TNBC), των οποίων οι όγκοι εκφράζουν PD-L1 (Συνδυασμένη Θετική Βαθμολογία [CPS] ≥ 10), όπως προσδιορίζεται από τεστ εγκεκριμένο από τον FDA. Τον Ιούλιο του 2021, ο FDA ενέκρινε το Pembrolizumab για τη θεραπεία ασθενών με υψηλού κινδύνου πρώιμου σταδίου τριπλού αρνητικού καρκίνου του μαστού (TNBC) σε συνδυασμό με χημειοθεραπεία ως νεο-επικουρική θεραπεία και στη συνέχεια τη χορήγησή του ως μεμονωμένου παράγοντα, ως επικουρική θεραπεία μετά από χειρουργική επέμβαση. |
| Palbociclib | 2015 | Σύμφωνα με την Ανασκόπηση του 2020 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., για το Palbociclib, το φάρμακο χορηγείται για τη θεραπεία του τοπικά προχωρημένου καρκίνου του μαστού ή του μεταστατικού καρκίνου του μαστού. Το Palbociclib μπορεί να χρησιμοποιείται μόνο όταν τα καρκινικά κύτταρα έχουν στην επιφάνειά τους υποδοχείς για ορισμένες ορμόνες (καρκίνος θετικός στους ορμονικούς υποδοχείς (HR)) και δεν παράγουν αφύσικα μεγάλες ποσότητες ενός άλλου υποδοχέα που ονομάζεται HER2 (καρκίνος αρνητικός [στον υποδοχέα τύπου 2 του ανθρώπινου επιδερμικού αυξητικού παράγοντα]). Το Palbociclib χρησιμοποιείται με τους ακόλουθους τρόπους: I) σε συνδυασμό με αναστολέα της αρωματάσης, II) σε συνδυασμό με φουλβεστράντη σε ασθενείς που έχουν λάβει προηγουμένως ορμονική θεραπεία. Σε προ-εμμηνοπαυσιακές γυναίκες, το Palbociclib πρέπει να χορηγείται σε συνδυασμό με ένα φάρμακο που ονομάζεται αγωνιστής της ορμόνης απελευθέρωσης της ωχρινοτρόπου ορμόνης. Ο FDA των ΗΠΑ, τον Φεβρουάριο του 2015, χορήγησε στο Palbociclib ταχεία έγκριση για τη θεραπεία του προχωρημένου (μεταστατικού) καρκίνου του μαστού. Τον Φεβρουάριο του 2016, ο FDA επεκτείνει τη χρήση των καψουλών Palbociclib 125 mg για τη θεραπεία του προχωρημένου ή μεταστατικού καρκίνου του μαστού θετικού σε ορμονικούς υποδοχείς (HR+), με αρνητικό υποδοχέα ανθρώπινου επιδερμικού αυξητικού παράγοντα 2 (HER2-) ή μεταστατικού καρκίνου του μαστού σε συνδυασμό με Fulvestrant, σε γυναίκες με εξέλιξη της νόσου μετά από ενδοκρινική θεραπεία. Στα τέλη Μαρτίου του 2017, ο FDA μετατρέπει την ταχεία έγκριση του Palbociclib σε τακτική έγκριση και διευρύνει το φάσμα της αντιορμονικής θεραπείας που μπορεί να χορηγηθεί με το φάρμακο αυτό. Τέλος, τον Απρίλιο του 2019, ο FDA επεκτείνει τις ενδείξεις για το Palbociclib για τον προχωρημένο ή μεταστατικό καρκίνο του μαστού, σε συνδυασμό με έναν αναστολέα αρωματάσης ή Fulvestrant, έτσι ώστε να συμπεριλάβει άνδρες με θετικούς ορμονικούς υποδοχείς (HR+), με αρνητικούς υποδοχείς 2 ανθρώπινου επιδερμικού αυξητικού παράγοντα (HER2). |
| Atezolizumab | 2016 | Σύμφωνα με την Ανασκόπηση του 2021 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., το Atezolizumab χορηγείται για τη θεραπεία διαφόρων μορφών καρκίνου, ανάμεσα στις οποίες ενός τύπου καρκίνου του μαστού που είναι γνωστός ως «τριπλά αρνητικός καρκίνος του μαστού». Συγκεκριμένα το Atezolizumab σε συνδυασμό με nab-πακλιταξέλη ενδείκνυται για τη θεραπεία ενήλικων ασθενών με ανεγχείρητο τοπικά προχωρημένο ή μεταστατικό τριπλά-αρνητικό καρκίνο του μαστού (TNBC) των οποίων οι όγκοι έχουν έκφραση του PD-L1 ≥ 1% και δεν έχουν λάβει προηγουμένως χημειοθεραπεία για μεταστατική νόσο. Αντίστοιχα, ο FDA, τον Μάρτιο του 2019, χορήγησε ταχεία έγκριση στο Atezolizumab μαζί με χημειοθεραπεία (nab-paclitaxel) για τη θεραπεία ενηλίκων με ανεγχείρητο τοπικά προχωρημένο ή μεταστατικό τριπλό αρνητικό καρκίνο του μαστού (TNBC), σε άτομα των οποίων οι όγκοι εκφράζουν PD-L1, όπως προσδιορίζεται από τεστ εγκεκριμένο από τον FDA. |
| Ribociclib | 2017 | Σύμφωνα με την Ανασκόπηση του 2020 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., το Ribociclib είναι αντικαρκινικό φάρμακο το οποίο χορηγείται για τη θεραπεία του τοπικά προχωρημένου καρκίνου του μαστού ή του μεταστατικού καρκίνου. Το Ribociclib μπορεί να χρησιμοποιείται μόνο όταν τα καρκινικά κύτταρα έχουν στην επιφάνειά τους υποδοχείς (στόχους) για ορισμένες ορμόνες (είναι θετικά σε ορμονικούς υποδοχείς) και δεν διαθέτουν μεγάλες ποσότητες ενός άλλου υποδοχέα που ονομάζεται HER2 (αρνητικά στον υποδοχέα 2 του ανθρώπινου επιδερμικού αυξητικού παράγοντα). Το φάρμακο πρέπει να χορηγείται πάντα σε συνδυασμό με ορμονοθεραπεία, η οποία μειώνει τη δράση των οιστρογόνων: είτε φουλβεστράντη (η οποία αναστέλλει τους υποδοχείς οιστρογόνων) είτε αναστολέα αρωματάσης (ο οποίος μειώνει τα επίπεδα των οιστρογόνων). Επίσης, αν το Ribociclib χρησιμοποιηθεί σε γυναίκες οι οποίες βρίσκονται στο στάδιο της προ-εμμηνόπαυσης ή περι-εμμηνόπαυσης (προεμμηνοπαυσιακές ή περιεμμηνοπαυσιακές γυναίκες), πρέπει να χορηγείται σε συνδυασμό με αναστολέα της LHRH (ένα φάρμακο που αναστέλλει τη δράση της εκλυτικής ορμόνης της ωχρινοτρόπου ορμόνης). Αντίστοιχα, ο FDA, τον Μάρτιο του 2017, ενέκρινε το Ribociclib για τον προχωρημένο ή μεταστατικό καρκίνο του μαστού, σε συνδυασμό με έναν αναστολέα της αρωματάσης, ως αρχική ενδοκρινική θεραπεία για τη θεραπεία μετεμμηνοπαυσιακών γυναικών με θετικούς ορμονικούς υποδοχείς, αρνητικού ανθρώπινου επιδερμικού αυξητικού παράγοντα υποδοχέα-2 (HR+/HER2-). Τον Ιούλιο του 2018, ο FDA ενέκρινε το Ribociclib για χρήση, μαζί με έναν αναστολέα αρωματάσης, για τη θεραπεία προ-, περι- ή μετεμμηνοπαυσιακών γυναικών στις ΗΠΑ, καθώς επίσης και για χρήση σε συνδυασμό με Fulvestrant ως πρώτης ή δεύτερης γραμμής θεραπεία σε μετεμμηνοπαυσιακές γυναίκες. |
| Abemaciclib | 2017 | Σύμφωνα με την Ανασκόπηση του 2018, από τον EMA και το αιτιολογικό έγκρισης στην Ε.Ε., το Abemaciclib ενδείκνυται για τη θεραπεία γυναικών με θετικό για ορμονικούς υποδοχείς (HR), αρνητικό για τον υποδοχέα 2 του ανθρώπινου επιδερμικού αυξητικού παράγοντα (HER2) τοπικά προχωρημένο ή μεταστατικό καρκίνο του μαστού σε συνδυασμό με έναν αναστολέα αρωματάσης ή φουλβεστράντη ως αρχική ενδοκρινική θεραπεία ή σε γυναίκες που έχουν λάβει προηγούμενη ενδοκρινική θεραπεία. Σε προ- ή περιεμμηνοπαυσιακές γυναίκες η ενδοκρινική θεραπεία θα πρέπει να συνδυάζεται με έναν αγωνιστή εκλυτικής ορμόνης της ωχρινοτρόπου ορμόνης (LHRH). Αντίστοιχα, ο FDA, τον Σεπτέμβριο του 2017, ενέκρινε το Abemaciclib για τη θεραπεία ενηλίκων ασθενών που έχουν θετικό για ορμονικό υποδοχέα (HR), αρνητικό για τον ανθρώπινο επιδερμικό αυξητικό παράγοντα 2 (HER2) – προχωρημένο ή μεταστατικό καρκίνο του μαστού που έχει προχωρήσει μετά από τη λήψη ενδοκρινικής θεραπείας. Τον Φεβρουάριο του 2018, ο FDA ενέκρινε το Abemaciclib, σε συνδυασμό με έναν αναστολέα αρωματάσης ως αρχική θεραπεία σε μετεμμηνοπαυσιακές γυναίκες με θετικούς ορμονικούς υποδοχείς (HR+), αρνητικούς για τον υποδοχέα 2 του ανθρώπινου επιδερμικού αυξητικού παράγοντα (HER2-) μεταστατικό καρκίνο του μαστού. Τέλος, τον Οκτώβριο του 2021, ο FDA ενέκρινε το Abemaciclib σε συνδυασμό με ενδοκρινική θεραπεία (ταμοξιφαίνη ή αναστολέας αρωματάσης), για επικουρική θεραπεία ενηλίκων ασθενών με θετικό στον ορμονικό υποδοχέα (HR+), αρνητικό για τον υποδοχέα 2 του ανθρώπινου επιδερμικού αυξητικού παράγοντα (HER2-), πρώιμο καρκίνο του μαστού (EBC) που παρουσιάζει υψηλό κίνδυνο υποτροπής και βαθμολογία Ki-67 ≥20%, όπως προσδιορίζεται από τεστ εγκεκριμένο από τον FDA. |
| Neratinib Maleate | 2017 | Σύμφωνα με την Ανασκόπηση του 2018 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., το Neratinib Maleate είναι φάρμακο κατά του καρκίνου του μαστού το οποίο χρησιμοποιείται για τη μείωση του κινδύνου υποτροπής της νόσου σε ασθενείς με πρώιμου σταδίου καρκίνο του μαστού οι οποίες υποβλήθηκαν σε χειρουργική επέμβαση. Χορηγείται κατόπιν θεραπείας με Trastuzumab. Προορίζεται για χρήση αποκλειστικά σε τύπους καρκίνου του μαστού όπου παράγονται υψηλά επίπεδα πρωτεΐνης HER2,–η οποία συμβάλλει στη διαίρεση και ανάπτυξη των κυττάρων (καρκίνος του μαστού θετικός στην HER2)– και στους οποίους υπάρχουν υποδοχείς (στόχοι) για τις θηλυκές γεννητικές ορμόνες (θετικός στους ορμονικούς υποδοχείς καρκίνος του μαστού). Αντίστοιχα, τον Ιούλιο του 2017, ο FDA ενέκρινε το Neratinib ως επικουρική θεραπεία του πρώιμου σταδίου, θετικού στο HER2 καρκίνου, του μαστού. Για τις ασθενείς με αυτόν τον τύπο καρκίνου, το Neratinib αποτέλεσε την πρώτη επικουρική θεραπεία που λαμβάνεται μετά από μια αρχική θεραπεία για τον καρκίνο του μαστού, έτσι ώστε να μειωθεί περαιτέρω ο κίνδυνος επανεμφάνισης του καρκίνου. Τον Φεβρουάριο του 2020, ο FDA ενέκρινε «supplemental New Drug Application» (συμπληρωματική Νέα Εφαρμογή Φαρμάκου [sNDA]) για το Neratinib, σε συνδυασμό με Capecitabine, για τη θεραπεία ενήλικων ασθενών με προχωρημένο ή μεταστατικό HER2 θετικό καρκίνο του μαστού που έχουν λάβει δύο ή περισσότερα προηγούμενα θεραπευτικά σχήματα με βάση το anti-HER2, για μεταστατικό καρκίνο. |
| Alpelisib | 2018 | Σύμφωνα με την Ανασκόπηση του 2020 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., το Alpelisib είναι ένα αντικαρκινικό φάρμακο που χρησιμοποιείται σε μετεμμηνοπαυσιακές γυναίκες και σε άνδρες για τη θεραπεία του καρκίνου του μαστού που είναι τοπικά προχωρημένος ή έχει εξαπλωθεί σε άλλα μέρη του σώματος. Το φάρμακο μπορεί να χρησιμοποιείται μόνο όταν τα καρκινικά κύτταρα είναι θετικά σε ορμονικούς υποδοχείς. Το Alpelisib ενδείκνυται σε συνδυασμό με φουλβεστράντη για τη θεραπεία μετεμμηνοπαυσιακών γυναικών και ανδρών με θετικό σε ορμονικό υποδοχέα (HR), αρνητικό σε υποδοχέα ανθρώπινου επιδερμικού αυξητικού παράγοντα 2 (HER2) τοπικά προχωρημένο ή μεταστατικό καρκίνο του μαστού με μετάλλαξη PIK3CA μετά την εξέλιξη της νόσου μετά από ενδοκρινική θεραπεία ως μονοθεραπεία. Αντίστοιχα, τον Μάιο του 2019, ο FDA των ΗΠΑ ενέκρινε τα δισκία alpelisib, σε συνδυασμό με Fulvestrant, για τη θεραπεία μετεμμηνοπαυσιακών γυναικών και ανδρών, με θετικό στον ορμονικό υποδοχέα (HR), ανθρώπινο επιδερμικό αυξητικό παράγοντα, αρνητικός στον υποδοχέα 2 (HER2), που παρουσιάζει τη μετάλλαξη PIK3CA, για προχωρημένο ή μεταστατικό καρκίνο του μαστού (όπως ανιχνεύεται από τεστ εγκεκριμένο από τον FDA) μετά από εξέλιξη της νόσου, ή μετά από θεραπεία με ένα ενδοκρινικό θεραπευτικό σχήμα. |
| Talazoparib Tosylate | 2018 | Σύμφωνα με την Ανασκόπηση του 2020 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., το Talazoparib είναι αντικαρκινικό φάρμακο το οποίο χρησιμοποιείται για τη θεραπεία ενός τύπου καρκίνου του μαστού (αρνητικός στον HER2 με μεταλλάξεις BRCA) ο οποίος έχει εξαπλωθεί πέρα από την αρχική εστία, σε ασθενείς που έχουν υποβληθεί σε θεραπεία με συγκεκριμένα φάρμακα τα οποία είτε δεν είναι πλέον αποτελεσματικά είτε δεν είναι κατάλληλα. Σύμφωνα με τις θεραπευτικές ενδείξεις, το φάρμακο χορηγείται ως μονοθεραπεία για την αντιμετώπιση του HER2 αρνητικού, τοπικά προχωρημένου ή μεταστατικού καρκίνου του μαστού σε ενήλικες ασθενείς με μεταλλάξεις BRCA1/2 της γαμετικής σειράς. Οι ασθενείς θα πρέπει να έχουν προηγουμένως λάβει θεραπεία με μια ανθρακυκλίνη ή/και ταξάνη στο (νεο)επικουρικό πλαίσιο θεραπείας, ή για τοπικά προχωρημένη ή μεταστατική νόσο, εκτός εάν οι ασθενείς δεν ήταν κατάλληλοι για αυτές τις θεραπείες. Οι ασθενείς με καρκίνο του μαστού θετικό για ορμονικούς υποδοχείς (hormone receptor, HR) θα πρέπει να έχουν λάβει προηγούμενη θεραπευτική αγωγή με βάση την ενδοκρινική θεραπεία ή να έχουν κριθεί ακατάλληλοι για θεραπεία με βάση την ενδοκρινική θεραπεία. Αντίστοιχα, τον Οκτώβριο του 2018, ο FDA ενέκρινε το Talazoparib, που είναι ένας αναστολέας των ενζύμων PARP και πιο συγκεκριμένα των PARP1 και PARP2, για ασθενείς με μεταλλάξεις BRCA1/2 [σειρά BRCA-mutated (gBRCAm)], HER2-αρνητικό, τοπικά προχωρημένο ή μεταστατικό καρκίνο του μαστού. Οι ασθενείς πρέπει να επιλέγονται για θεραπεία με βάση ένα εγκεκριμένο από τον FDA συνοδευτικό διαγνωστικό τεστ για την Talazoparib. |
| fam-trastuzumab deruxtecan-nxki | 2019 | Σύμφωνα με την Ανασκόπηση του 2020 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., τo Trastuzumab Deruxtecan είναι φάρμακο που χρησιμοποιείται στη θεραπεία του καρκίνου του μαστού που είναι μεταστατικός ή δεν μπορεί να αφαιρεθεί χειρουργικά. Το Trastuzumab Deruxtecan είναι ένα σύζευγμα αντισώματος-φαρμάκου που στοχεύει τον HER2 και η λειτουργία του τμήματος αντισώματος είναι να προσδεθεί στον HER2 που εκφράζεται στην επιφάνεια ορισμένων καρκινικών κυττάρων. Στις θεραπευτικές ενδείξεις του φαρμάκου αναφέρεται ότι το Trastuzumab Deruxtecan ενδείκνυται ως μονοθεραπεία για τη θεραπεία ενήλικων ασθενών με ανεγχείρητο ή μεταστατικό HER2-θετικό καρκίνο του μαστού που έχουν λάβει δύο ή περισσότερα προηγούμενα σχήματα βασισμένα σε αγωγή έναντι του HER2. Αντίστοιχα, τον Δεκέμβριο του 2019, ο FDA των ΗΠΑ ενέκρινε το Fam-Trastuzumab Deruxtecan-nxki για ασθενείς με ανεγχείρητο ή μεταστατικό HER2 θετικό καρκίνο του μαστού, σε ασθενείς που έχουν προηγουμένως λάβει δύο η περισσότερες αντι-HER2 θεραπευτικά σχήματα. |
| Tucatinib | 2020 | Σύμφωνα με την Ανασκόπηση του 2020 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., το Tucatinib είναι αντικαρκινικό φάρμακο για τη θεραπεία του καρκίνου του μαστού ο οποίος είναι τοπικά προχωρημένος ή μεταστατικός ή είναι θετικός στην HER2. Σύμφωνα με τις θεραπευτικές ενδείξεις, το φάρμακο χορηγείται σε συνδυασμό με Trastuzumab και Capecitabine για τη θεραπεία ενήλικων ασθενών με HER2-θετικό, τοπικά προχωρημένο ή μεταστατικό καρκίνο του μαστού οι οποίοι έχουν λάβει τουλάχιστον δύο προηγούμενες αντι-HER2 θεραπευτικές αγωγές. Αντίστοιχα, τον Απρίλιο του 2020, ο FDA ενέκρινε τα δισκία Tucatinib, σε συνδυασμό με Trastuzumab και Capecitabine, για ενήλικες ασθενείς με προχωρημένο ανεγχείρητο ή μεταστατικό HER2 θετικό καρκίνο του μαστού, συμπεριλαμβανομένων ασθενών με εγκεφαλικές μεταστάσεις, οι οποίοι έχουν λάβει προηγουμένως ένα ή περισσότερα αντι-HER2 θεραπευτικά σχήματα. |
| Sacituzumab Govitecan-hziy | 2020 | Σύμφωνα με την Ανασκόπηση του 2021 από τον ΕΜΑ και το αιτιολογικό έγκρισης στην Ε.Ε., το Sacituzumab Govitecan είναι αντικαρκινικό φάρμακο που χρησιμοποιείται για τη θεραπεία ενηλίκων με έναν τύπο καρκίνου του μαστού γνωστό ως τριπλά-αρνητικό καρκίνο του μαστού. Σύμφωνα με τις θεραπευτικές ενδείξεις, το φάρμακο ενδείκνυται ως μονοθεραπεία για τη θεραπεία ενήλικων ασθενών με ανεγχείρητο ή μεταστατικό τριπλά αρνητικό καρκίνο του μαστού (mTNBC), οι οποίοι έχουν λάβει δύο ή περισσότερες προηγούμενες συστηματικές θεραπείες, συμπεριλαμβανομένης τουλάχιστον μίας εξ αυτών για προχωρημένη νόσο. Αντίστοιχα, τον Απρίλιο του 2020, ο FDA ενέκρινε το Sacituzumab Govitecan-hziy για τη θεραπεία ενήλικων ασθενών με μεταστατικό τριπλό αρνητικό καρκίνο του μαστού (TNBC) που έχουν λάβει τουλάχιστον δύο προηγούμενες θεραπείες για μεταστατική νόσο. Τον Απρίλιο του 2021, ο FDA χορήγησε πλήρη έγκριση στο Sacituzumab Govitecan-hziy για ενήλικες ασθενείς με ανεγχείρητο τοπικά προχωρημένο ή μεταστατικό τριπλά αρνητικό καρκίνο του μαστού (TNBC), για ασθενείς που έχουν λάβει δύο ή περισσότερες συστηματικές θεραπείες, εκ των οποίων η μία τουλάχιστον από αυτές για μεταστατική νόσο. |
| Margetuximab-cmkb | 2020 | Τον Δεκέμβριο του 2020, ο FDA ενέκρινε το Margetuximab-cmkb, σε συνδυασμό με χημειοθεραπεία, για τη θεραπεία ενήλικων ασθενών με μεταστατικό HER2-θετικό καρκίνο του μαστού, οι οποίοι έχουν λάβει δύο ή περισσότερα προηγούμενα σχήματα anti-HER2, και τουλάχιστον ένα από τα θεραπευτικά σχήματα που έλαβαν αφορούσε μεταστατική νόσο. Το φάρμακο δεν έχει ακόμη κυκλοφορήσει στην Ευρώπη και σύμφωνα με το SPS (Specialist Pharmacy Service) του Ηνωμένου Βασιλείου, βρίσκεται στη φάση ανάπτυξης (Phase III Clinical Trials) τόσο στην Ε.Ε., όσο και στο Ηνωμένο Βασίλειο. |




 θεραπεία πρώτης επιλογής
θεραπεία πρώτης επιλογής Η χορήγηση βιολογικών παραγόντων στην ψωρίαση
Η χορήγηση βιολογικών παραγόντων στην ψωρίαση




 Συμπέρασμα
Συμπέρασμα

 Εμείς, στο σημερινό μας άρθρο, θα αναφέρουμε χαρακτηριστικά ορισμένους από αυτούς τους στόχους που θα μας επιτρέψουν να προσδιορίσουμε καλύτερα τις διαστάσεις των πολιτικών υγείας αλλά και την ανάγκη να συνειδητοποιήσουμε ότι, πέρα από την αντιμετώπιση των προβλημάτων υγείας και την οργάνωση των συστημάτων υγείας που θα μας βοηθήσουν να αντιμετωπίσουμε αυτά τα προβλήματα αποτελεσματικότερα, είναι απαραίτητο να επενδύσουμε στην προαγωγή της υγείας και στην πρόληψη της ασθένειας.
Εμείς, στο σημερινό μας άρθρο, θα αναφέρουμε χαρακτηριστικά ορισμένους από αυτούς τους στόχους που θα μας επιτρέψουν να προσδιορίσουμε καλύτερα τις διαστάσεις των πολιτικών υγείας αλλά και την ανάγκη να συνειδητοποιήσουμε ότι, πέρα από την αντιμετώπιση των προβλημάτων υγείας και την οργάνωση των συστημάτων υγείας που θα μας βοηθήσουν να αντιμετωπίσουμε αυτά τα προβλήματα αποτελεσματικότερα, είναι απαραίτητο να επενδύσουμε στην προαγωγή της υγείας και στην πρόληψη της ασθένειας.