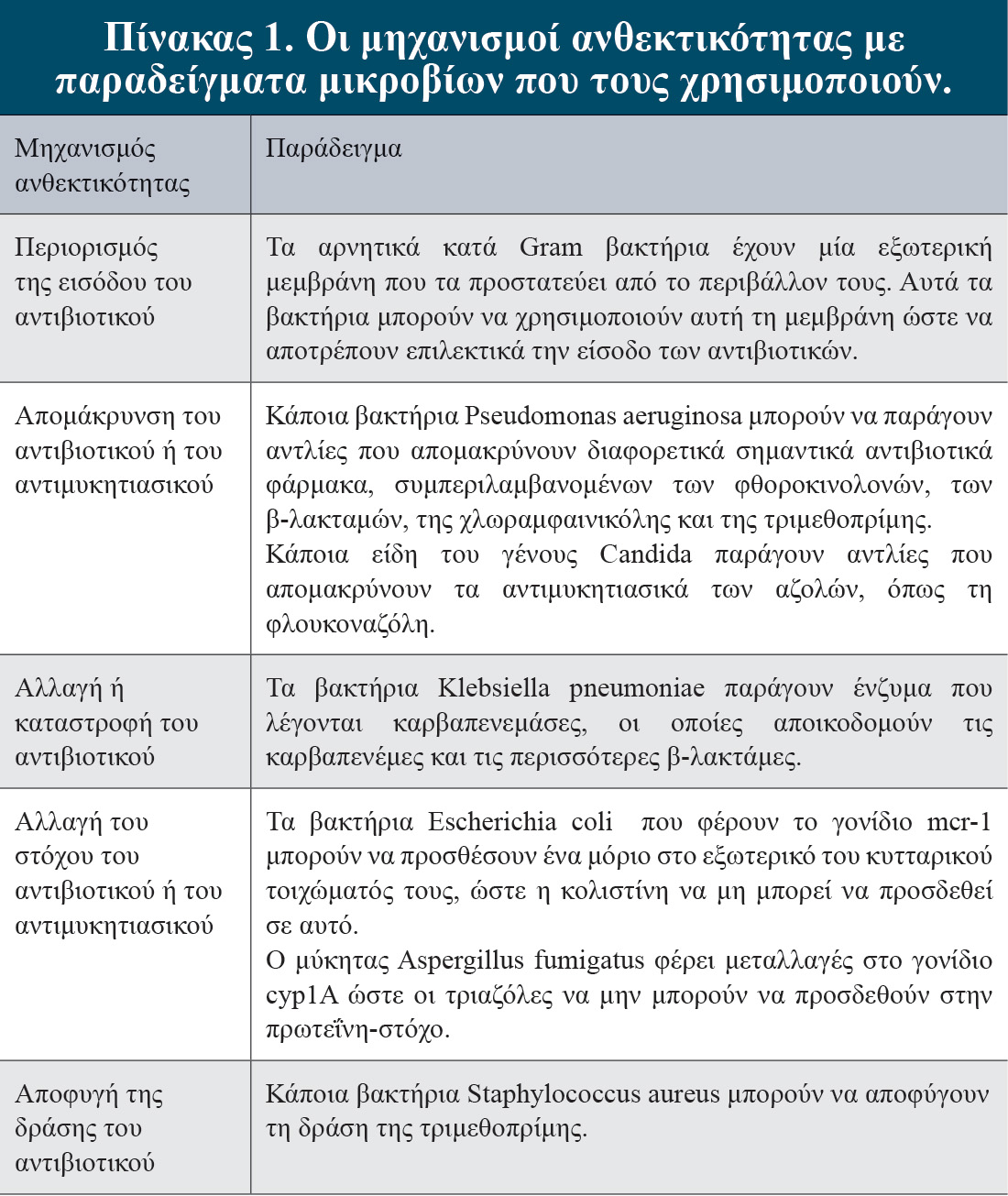
Στην Ελλάδα, το ποσοστό των ατόμων που ζούσαν με παχυσαρκία το 2019 ήταν ακόμα πιο μεγάλο από τον παγκόσμιο μέσο όρο του 2016, με σχεδόν 17% των ενήλικων ατόμων να είναι παχύσαρκα, ενώ 41% των ατόμων ήταν υπέρβαρα. Ακόμα πιο ανησυχητικά, το ποσοστό των παχύσαρκων παιδιών στην Ελλάδα το 2022 είναι το υψηλότερο στην Ευρώπη (35%), με 1 στα 3 παιδιά να ζουν με παχυσαρκία.
Οι προβλέψεις είναι δυσοίωνες, μιας και εκτιμάται ότι μέχρι το έτος 2035 σχεδόν 2 δισεκατομμύρια άνθρωποι (ενήλικες, έφηβοι, και παιδιά), δηλαδή το 24% του παγκόσμιου πληθυσμού, θα ζουν με παχυσαρκία. Η αύξηση στον επιπολασμό της παχυσαρκίας συνεισφέρει στην αυξημένη νοσηρότητα και θνησιμότητα – τα ενήλικα άτομα που ζουν με παχυσαρκία κατά την τρίτη δεκαετία της ζωής τους έχουν μειωμένο προσδόκιμο ζωής από 5,6 έως 10,3 χρόνια.
Το έτος 2019, οι πρόωροι θάνατοι εξαιτίας της παχυσαρκίας εκτιμήθηκαν στα 5 εκατομμύρια, με κύρια αιτία θανάτου σχετιζόμενη με την παχυσαρκία την καρδιαγγειακή νόσο, ακολουθούμενη από τη χρόνια νεφρική νόσο, τον σακχαρώδη διαβήτη τύπου 2 (ΣΔΤ2) και διάφορους τύπους καρκίνου. Αν και αυτές οι παθήσεις αποτελούν τις πιο συχνές επιπλοκές της, η παχυσαρκία επηρεάζει επιπρόσθετα και σημαντικά την ψυχική υγεία, τη γενική ποιότητα ζωής, τη φυσική κατάσταση και τη σεξουαλική λειτουργία.
Η κοινή πολυγονιδιακή παχυσαρκία προκύπτει από την υπερκατανάλωση πολύ γευστικών, ενεργειακά πυκνών τροφίμων σε συνδυασμό με την αυξημένη καθιστική ζωή. Η αλληλεπίδραση αυτών των περιβαλλοντικών στοιχείων συνεισφέρει σημαντικά σε ένα θετικό ενεργειακό ισοζύγιο και στη συσσώρευση της περισσής ενέργειας στις αποθήκες σωματικού λίπους. Κρίσιμα, υπάρχει ένα ισχυρό γενετικό στοιχείο το οποίο καθορίζει την απόκριση του κάθε ατόμου σε αυτό το περιβάλλον που προωθεί την εξέλιξη της παχυσαρκίας.
Σε ορισμένα άτομα, το υπερβολικό σωματικό λίπος συσσωρεύεται κυρίως στον ενδοκοιλιακό λιπώδη ιστό και μπορεί επίσης να διεισδύσει σε άλλα σπλαχνικά όργανα, ενισχύοντας τον καρδιομεταβολικό κίνδυνο.
Ο λιπώδης ιστός είναι κάτι περισσότερο από μια αποθήκη περίσσειας ενέργειας, καθώς είναι ένα ενεργό ενδοκρινικό και παρακρινικό όργανο που εκκρίνει μυριάδες ορμόνες, αδιποκίνες και φλεγμονώδεις κυτταροκίνες που έχουν βασικούς ρόλους στη ρύθμιση της ενεργειακής ομοιόστασης, της ανοσοαπόκρισης και της φλεγμονής.
Στην παχυσαρκία, ο λιπώδης ιστός απορυθμίζεται, πυροδοτώντας μία αλληλουχία προφλεγμονωδών βημάτων, οδηγώντας στη συστηματική αντίσταση στην ινσουλίνη και έτσι τελικά προκαλώντας την απορρύθμιση των επιπέδων της γλυκόζης και των λιπαρών οξέων. Αυτή η απορρύθμιση προκαλεί βλάβες στα όργανα όπως οι αρτηρίες, η καρδιά, το ήπαρ, οι σκελετικοί μύες και το πάγκρεας, περαιτέρω συμβάλλοντας σε συστηματικές ορμονικές, μεταβολικές και οργανικές αλλοιώσεις. Η παρουσία τέτοιων ανεπιθύμητων ενεργειών που σχετίζονται με την παχυσαρκία συσχετίζεται με το μέγεθος του υπερβολικού σωματικού βάρους και την κατανομή του.
Οι περισσότερες από τις βλαβερές συνέπειες της παχυσαρκίας μπορούν να μετριαστούν, να αντιστραφούν, ή να προληφθούν με τη μείωση του σωματικού βάρους. Ωστόσο, αυτό αποδεικνύεται σε μία μεγάλη πρόκληση, καθώς η απώλεια βάρους ενεργοποιεί πολλούς κεντρικούς και περιφερειακούς αντισταθμιστικούς μηχανισμούς, συμπεριλαμβανομένων των πολύπλοκων και επίμονων ορμονικών και μεταβολικών προσαρμογών στα σήματα πείνας και κορεσμού, που αντιτίθενται στη μείωση του βάρους και ευνοούν την ανάκτηση του. Επιπλέον, μικρές αυξήσεις στο σωματικό βάρος γίνονται μόνιμες σε σχετικά σύντομο χρονικό διάστημα.
Η πολύπλοκη παθοφυσιολογία της παχυσαρκίας και η σημαντική επίδρασή της στην υγεία, την καθιστούν περισσότερο μία χρόνια πάθηση παρά έναν ακόμα παράγοντα κινδύνου. Ωστόσο, η παχυσαρκία δεν είναι ακόμη αναγνωρισμένη παγκοσμίως ως τη χρόνια και προοδευτική ασθένεια που στην πραγματικότητα είναι. Δυστυχώς, τα άτομα με παχυσαρκία στιγματίζονται επίμονα καθώς η παχυσαρκία θεωρείται ως επιλογή τρόπου ζωής ενός ατόμου από το ευρύτερο κοινό και σε κάποιες περιπτώσεις από ορισμένους επαγγελματίες υγείας. Ως εκ τούτου, πολύ συχνά η παχυσαρκία δεν αντιμετωπίζεται θεραπευτικά.
Παρόμοια με άλλες χρόνιες παθήσεις, η παχυσαρκία απαιτεί θεραπευτικές παρεμβάσεις και την υιοθέτηση κατάλληλων μακροπρόθεσμων υγιεινοδιαιτητικών και φαρμακευτικών στρατηγικών.
Χρησιμοποιώντας ως βασική πηγή το άρθρο του M. Blüher και των συνεργατών του που δημοσιεύτηκε πολύ πρόσφατα (Αύγουστος 2023) στο επιστημονικό περιοδικό ‘Diabetes, Obesity and Metabolism’, θα εστιάσουμε στις μέχρι τώρα διαθέσιμες φαρμακευτικές παρεμβάσεις για την αντιμετώπιση της παχυσαρκίας, καθώς και στις νεότερες θεραπευτικές εξελίξεις του πεδίου.
Φαρμακευτική διαχείριση της παχυσαρκίας
Διαθέσιμες φαρμακευτικές επιλογές για την απώλεια βάρους
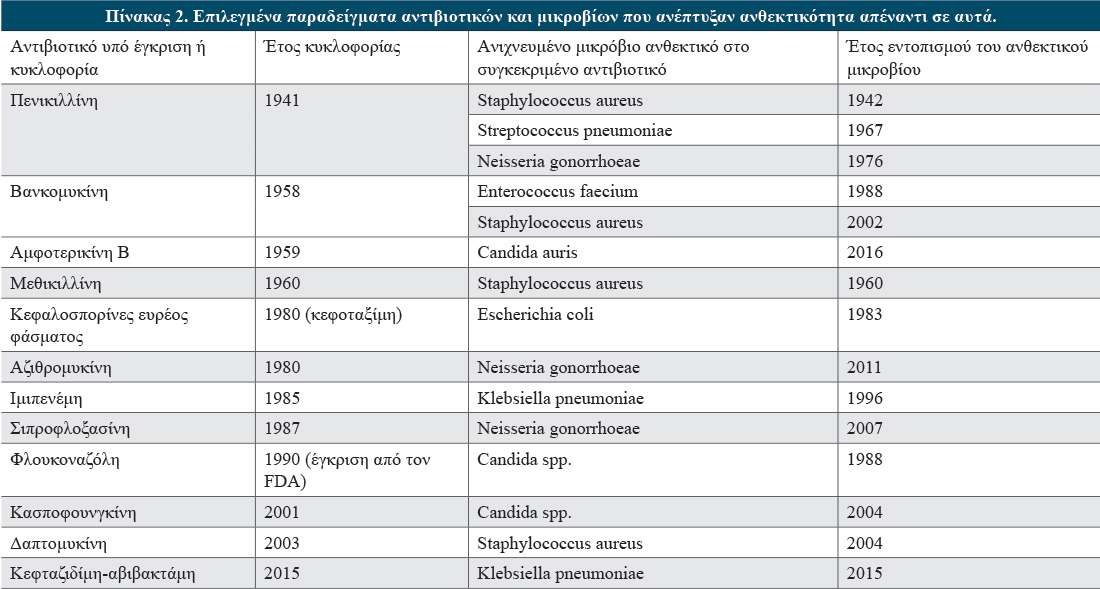
Επί του παρόντος πέντε φαρμακευτικοί παράγοντες είναι διαθέσιμοι για τη χρόνια διαχείριση βάρους των ενήλικων ατόμων στις Ηνωμένες Πολιτείες της Αμερικής (ΗΠΑ) ή/και στην Ευρωπαϊκή Ένωση. Μεταξύ αυτών είναι η ορλιστάτη (orlistat), η φαιντερμίνη (phentermine)/τοπιραμάτη (topiramate) παρατεταμένης αποδέσμευσης (ΠΑ), η ναλτρεξόνη (naltrexone) ΠΑ/βουπροπιόνη (bupropion) ΠΑ και οι αγωνιστές του υποδοχέα του γλυκαγονόμορφου πεπτιδίου-1 (glucagon like peptide-1 receptor agonists, GLP-1RAs) λιραγλουτίδη (liraglutide) και σεμαγλουτίδη (semaglutide) (Πίνακας 1). Για τη θεραπεία σπάνιων μονογονιδιακών παχυσαρκιών, ο αγωνιστής του υποδοχέα της μελανοκορτίνης-4 (melanocortin-4 receptor, MC4R) σετμελανοτίδη (setmelanotide) ενδείκνυται σε ενήλικα άτομα και παιδιά ηλικίας 6 ετών και άνω.
Όλοι αυτοί οι παράγοντες έχουν ως αποτέλεσμα την κλινικά σημαντική μείωση βάρους. Η συνεχής χρήση της ορλιστάτης, της σεμαγλουτίδης και των συνδυαστικών σκευασμάτων της φαιντερμίνης/τοπιραμάτης ΠΑ και της βουπροπιόνης ΠΑ/ναλτρεξόνης ΠΑ συνιστάται μόνο όταν η απώλεια βάρους είναι της τάξης του τουλάχιστον 5% στους πρώτους 3 μήνες της θεραπείας (ή τουλάχιστον 4% στις 16 εβδομάδες χρήσης για τη λιραγλουτίδη) και μπορεί να συνεχιστεί εφόσον η θεραπεία παρέχει όφελος και δεν συμβαίνουν σοβαρά ανεπιθύμητα συμβάντα.
Προφανώς, ο συνδυασμός άσκησης και φαρμακευτικής θεραπείας μειώνει τους παράγοντες κινδύνου σε άτομα με παχυσαρκία και έτσι αυξάνει τη γενική τους υγεία και ποιότητα ζωής. Επιπλέον, ο συνδυασμός φυσικής δραστηριότητας και φαρμακευτικής αγωγής κατά της παχυσαρκίας αποτρέπει αποτελεσματικά την επανάκτηση βάρους. Η φυσική δραστηριότητα θεωρείται απαραίτητη προϋπόθεση για τη συνταγογράφηση φαρμάκων κατά της παχυσαρκίας, κάτι που αντικατοπτρίζεται στις ρυθμιστικές εγκρίσεις των φαρμακευτικών παραγόντων που συνοψίζονται στις ακόλουθες ενότητες.
Συγκεκριμένα, οι οδηγίες/ρυθμιστικές εγκρίσεις ορίζουν ότι αυτοί οι φαρμακευτικοί παράγοντες πρέπει να χρησιμοποιούνται ως επικουρική θεραπεία στις υγιεινοδιαιτητικές παρεμβάσεις.

b Αποτελέσματα στα πλαίσια ταυτόχρονων υγιεινοδιαιτητικών προσαρμογών.
c Συνιστώμενη δόση, με μέγιστη συνιστώμενη δόση τα 15 mg/92 mg.
d Η τυπική δόση μπορεί να αυξηθεί έως τα 360 mg/32 mg μία φορά ημερησίως.
e Συνιστώμενη δόση για ενήλικα άτομα και παιδιά έως ηλικίας ≥6 ετών. Η συνιστώμενη δόση έναρξης θεραπείας για ενήλικα άτομα και παιδιά ≥12 ετών είναι τα 2 mg και για παιδιά μεταξύ 6-12 ετών είναι το 1 mg, μία φορά ημερησίως για 2 εβδομάδες.
f Το ποσοστό αυτό ήταν εύρημα μελετών μονού σκέλους δίχως την ύπαρξη συγκριτικού σκέλους με εικονικό φάρμακο και αφορά το 80% των συμμετεχόντων με ανεπάρκεια προοπιομελανοκορτίνης και 45% αυτών με ανεπάρκεια του υποδοχέα της λεπτίνης περίπου μετά από 1 χρόνο θεραπείας.

*Η μέση αλλαγή σωματικού βάρους στην ομάδα της ορλιστάτης εκφράζεται σε kg σωματικού βάρους και όχι σε ποσοστό (διακεκομμένο ραβδόγραμμα).
Ορλιστάτη
Η ορλιστάτη έχει λάβει έγκριση στην Ευρώπη και τις ΗΠΑ για τη χρόνια διαχείριση βάρους στα ενήλικα άτομα, ενώ μόνο στις ΗΠΑ έχει εγκριθεί για χρήση σε παιδιά ηλικίας 12 ετών και άνω. Είναι ένας εκλεκτικός αναστολέας της γαστρικής και παγκρεατικής λιπάσης και δρα τοπικά στον αυλό του εντέρου μέσω της μείωσης της απορρόφησης του λίπους κατά περίπου 30%, μειώνοντας έτσι τη θερμιδική πρόσληψη. Η ορλιστάτη σχετίζεται με μέτρια απώλεια βάρους. Μετά από ένα έτος θεραπείας με ορλιστάτη σε συνδυασμό με χαμηλή σε λιπαρά διατροφή, η μέση απώλεια βάρους, προσαρμοσμένη μείον αυτής που παρατηρήθηκε για το εικονικό φάρμακο, ήταν 3,4 κιλά (3,1 % του αρχικού βάρους). Η κλινικά σημαντική (≥5%) απώλεια σωματικού βάρους με ορλιστάτη κυμαινόταν από 35% έως 73%. Στην 4-ετή μελέτη XENDOS, η θεραπεία με ορλιστάτη οδήγησε σε προσαρμοσμένη (για το εικονικό φάρμακο) απώλεια βάρους 2,8 kg (2,4% του αρχικού βάρους). Ωστόσο, αυτή η μέτρια μείωση βάρους μεταφράστηκε σε 37,3% μείωση του κινδύνου για διαβήτη.
Φαιντερμίνη/τοπιραμάτη
Η φαιντερμίνη έχει εγκριθεί στις ΗΠΑ για τη βραχυπρόθεσμη (έως 12 εβδομάδες) διαχείριση της παχυσαρκίας. Είναι ένα συμπαθομιμητικό ανάλογο αμφεταμίνης που καταστέλλει την όρεξη μέσω της δράσης της ως αγωνιστής της σεροτονίνης, της νορεπινεφρίνης και της ντοπαμίνης στο κεντρικό νευρικό σύστημα. Σε συνεργιστικό συνδυασμό με την τοπιραμάτη, ένα αντισπασμωδικό που χρησιμοποιείται για τη θεραπεία των επιληπτικών κρίσεων και τους πονοκεφάλους ημικρανίας, το ανορεκτικό αποτέλεσμα της φαιντερμίνης ενισχύεται περαιτέρω. Στις δύο μεγάλες δοκιμές CONQUER και EQUIP που διήρκησαν μέχρι ένα έτος, η μέση προσαρμοσμένη μείωση βάρους που αποδόθηκε στον θεραπευτικό συνδυασμό κυμαινόταν από 8,6% έως 9,3% με τη δόση των 15 mg φαιντερμίνης/92 mg τοπιραμάτης σε συνδυασμό με την υιοθέτηση ενός τρόπου ζωής χαμηλής έντασης από άποψη φυσικής άσκησης.
Σε αυτές τις μελέτες, το 67% έως 70% των συμμετεχόντων που έλαβαν τη δόση των 15 mg φαιντερμίνης/92 mg τοπιραμάτης έχασαν τουλάχιστον το 5% του αρχικού σωματικού βάρους τους συγκριτικά με το 17,3% και 21%, αντίστοιχα, των συμμετεχόντων που έλαβαν το εικονικό φάρμακο (P<0,0001).
Η μελέτη SEQUEL, η οποία ήταν μια μελέτη επέκτασης της CONQUER, επιβεβαίωσε τη διατηρούμενη αποτελεσματικότητα του συνδυασμού της φαιντερμίνης/τοπιραμάτης, παρατηρώντας προσαρμοσμένη απώλεια βάρους 8,7% σε σύνολο 108 εβδομάδων. Επιπλέον, παρατηρήθηκε σημαντικά χαμηλότερη συχνότητα εμφάνισης της εξέλιξης του διαβήτη στην ομάδα των 15 mg/92 mg (0,9%) έναντι αυτής του εικονικού φαρμάκου (3,7%), καθώς και χαμηλότερο ποσοστό ανεπιθύμητων ενεργειών σε σύγκριση με τη μελέτη CONQUER.
Βουπροπριόνη/ναλτρεξόνη
Η θεραπεία συνδυασμού με βουπροπιόνη και ναλτρεξόνη βασίζεται στην αρχή ενός συνεργιστικού συνδυασμού δύο κεντρικά δραστικών φαρμακευτικών παραγόντων, οι οποίοι είχαν ήδη εγκριθεί και οι οποίοι, λαμβανόμενοι χωριστά, οδηγούν σε μέτρια απώλεια βάρους. Η βουπροπιόνη είναι εγκεκριμένη για τη θεραπεία της μονοπολικής κατάθλιψης, της εποχιακής συναισθηματικής διαταραχής και για χρήση κατά τη διακοπή του καπνίσματος, επηρεάζοντας φαρμακευτικά την κεντρική αντίληψη της ανταμοιβής. Είναι ένας μη εκλεκτικός αναστολέας των μεταφορέων της ντοπαμίνης και της νορεπινεφρίνης.
Αντίστοιχα, η ναλτρεξόνη είναι ένας ανταγωνιστής των υποδοχέων των οπιοειδών που χρησιμοποιείται ευρέως για τη θεραπεία συνδρόμων εθισμού, συμπεριλαμβανομένης της διαταραχής χρήσης αλκοόλ και οπιοειδών. Με βάση μελέτες σε ζώα, η ανορεκτική επίδραση του θεραπευτικού συνδυασμού της βουπροπιόνης/ναλτρεξόνης αποδίδεται στη διέγερση της έκκρισης προοπιομελανοκορτίνης (proopiomelanocortin, POMC) στον τοξοειδή πυρήνα του υποθάλαμου, με αποτέλεσμα τη μειωμένη επιθυμία για φαγητό, τον αυξημένο κορεσμό και εμμέσως την αυξημένη ενεργειακή δαπάνη.
Το πρόγραμμα κλινικών δοκιμών Contrave Obesity Research (COR) αξιολόγησε την αποτελεσματικότητα και την ασφάλεια του συνδυασμού βουπροπιόνης/ναλτρεξόνης. Στη δοκιμές COR-I50 και COR-II51, οι συμμετέχοντες έλαβαν μία ημερήσια δόση των 360 mg βουπροπιόνης/32 mg ναλτρεξόνης σε συνδυασμό με ήπια υποθερμιδική δίαιτα και άσκηση ή συμβουλές τροποποίησης του τρόπου ζωής, αντίστοιχα. Μετά από 1 έτος θεραπείας, ο συνδυασμός της βουπροπιόνης/ναλτρεξόνης προκάλεσε μια μέση προσαρμοσμένη (για το εικονικό φάρμακο) μείωση βάρους που κυμάνθηκε από 4,8% έως 5,2%. Συνολικά, 48% έως 50% των συμμετεχόντων που έλαβαν τον θεραπευτικό συνδυασμό έχασαν ≥5% του αρχικού σωματικού βάρους σε σύγκριση με το περίπου 17% της ομάδας που έλαβε εικονικό φάρμακο. Επιπρόσθετα, η προσθήκη 360 mg βουπροπιόνης/32 mg ναλτρεξόνης σε ένα πρόγραμμα εντατικής τροποποίησης συμπεριφοράς μελετήθηκε στη μελέτη COR Behavioural Modification, η οποία κατέδειξε την προσαρμοσμένη μείωση του σωματικού βάρους κατά 4,2%.
Λιραγλουτίδη
Οι GLP-1RAs είναι καθιερωμένοι παράγοντες μείωσης της γλυκόζης με καρδιοπροστατευτική δράση σε άτομα με ΣΔΤ2. Εν τω μεταξύ, η λιραγλουτίδη και η σεμαγλουτίδη έχει αποδειχθεί ότι προάγουν την απώλεια βάρους σε υπέρβαρα και παχύσαρκα άτομα εν απουσία ΣΔΤ2. Η επίδραση απώλειας βάρους αυτής της κατηγορίας φαρμάκων επιτυγχάνεται με τη μίμηση του γλυκανόμορφου πεπτιδίου-1 (glucagon-like peptide-1, GLP-1), η οποία ρυθμίζει την όρεξη και την πρόσληψη τροφής στον εγκέφαλο και καθυστερεί τη γαστρική κένωση. Και τα δύο φάρμακα έχουν εγκριθεί στις ΗΠΑ και την Ευρώπη για τη διαχείριση της παχυσαρκίας σε ενήλικα άτομα ως συμπληρωματικό μέτρο αντιμετώπισης της πάθησης, σε συνδυασμό με τη μείωση της θερμιδικής πρόσληψης και την αυξημένη σωματική δραστηριότητα. Ο Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων (Food and Drug Administration, FDA) και o Ευρωπαϊκός Οργανισμός Φαρμάκων (European Medicines Agency, EMA) έχουν επίσης εγκρίνει τη λιραγλουτίδη για τη θεραπεία παιδιών ηλικίας 12 ετών και άνω με παχυσαρκία. Η θεραπεία με λιραγλουτίδη έχει αποδειχθεί ότι ωφελεί τα ασθενή άτομα με παχυσαρκία που προκαλείται από μεταλλάξεις στο γονίδιο MC4R. Ωστόσο, η λιραγλουτίδη δεν έχει εγκριθεί για αυτή την ένδειξη.
Το πρόγραμμα κλινικών δοκιμών SCALE αποτέλεσε τη βάση για την έγκριση της λιραγλουτίδης, στη δόση των 3,0 mg, για τη διαχείριση του σωματικού βάρους. Στις μελέτες του προγράμματος παρατηρήθηκε σημαντική απώλεια βάρους (προσαρμοσμένη μείον αυτής του εικονικού φαρμάκου), της τάξης του 5,4% στο 1 έτος και 4,4% στα 3 έτη θεραπείας με τη δόση των 3,0 mg της λιραγλουτίδης σε συνδυασμό με αλλαγές στον τρόπο ζωής (συμβουλευτική ή μείωση θερμίδων και αυξημένη σωματική δραστηριότητα, αντίστοιχα). Κατά τον πρώτο χρόνο της θεραπείας, η λιραγλουτίδη οδήγησε σε μείωση του σωματικού βάρους κατά ≥5% στο 63,2% των ατόμων της ομάδας ενεργού θεραπείας συγκριτικά με το 27,1% των ατόμων της ομάδας του εικονικού φαρμάκου. Από αυτή την ομάδα ασθενών, περίπου το 60% παρουσίαζε προδιαβήτη. Σε αυτά τα άτομα, η θεραπεία της λιραγλουτίδης παρατάθηκε για επιπλέον 2 χρόνια για να καθοριστεί η επίδραση της στη μείωση του κινδύνου εξέλιξης σε ΣΔΤ2. Πράγματι, λιγότερες περιπτώσεις εξέλιξης του ΣΔΤ2 διαγνώστηκαν στην ομάδα που έλαβε λιραγλουτίδη (1,8%) από ότι στην ομάδα που έλαβε εικονικό φάρμακο (6,2%) κατά τη διάρκεια της δοκιμής.
Η επίδραση της λιραγλουτίδης στην απώλεια βάρους ήταν λιγότερο έντονη σε δύο περαιτέρω δοκιμές του προγράμματος SCALE με παρακολούθηση 1 έτους. Στη δοκιμή SCALE Diabetes, η προσαρμοσμένη απώλεια βάρους ήταν 3,9% σε άτομα με ΣΔΤ2, και στη δοκιμή SCALE IBT, η λιραγλουτίδη, στη δόση των 3,0 mg και σε συνδυασμό με εντατική συμπεριφορική θεραπεία, οδήγησε σε προσαρμοσμένη απώλεια βάρους της τάξης του 3,4%. Τέλος, η παρατεταμένη απώλεια βάρους με λιραγλουτίδη (δόση 3,0 mg) αξιολογήθηκε στη δοκιμή SCALE Maintenance. Πριν από την τυχαιοποίηση της θεραπείας, οι συμμετέχοντες έχασαν επιτυχώς ≥5% του αρχικού σωματικού βάρους μέσω του θερμιδικού περιορισμού. Αυτό το αποτέλεσμα στην απώλεια βάρους όχι μόνο διατηρήθηκε αλλά ενισχύθηκε περαιτέρω από τη λιραγλουτίδη, με αποτέλεσμα τη μέση προσαρμοσμένη συνολική απώλεια βάρους του 12,2% σε ένα χρόνο (6,1% ήταν η μέση απώλεια βάρους για τα άτομα που έλαβαν εικονικό φάρμακο). Επιπλέον, τα συμμετέχοντα άτομα στην ομάδα θεραπείας με λιραγλουτίδη ήταν πιο πιθανό να διατηρήσουν την αρχική απώλεια βάρους της τάξης του ≥5% (81%), αλλά και πιο πιθανό να χάσουν επιπλέον ≥5% του βάρους που είχαν κατά την τυχαιοποίηση της μελέτης (51%), σε σύγκριση με την ομάδα που έλαβε εικονικό φάρμακο (49% και 22%, αντίστοιχα).
Σεμαγλουτίδη
Παρόμοια με τη λιραγλουτίδη, η σεμαγλουτίδη είναι ένα ανάλογο του υποδοχέα GLP-1, το οποίο εγκρίθηκε ως θεραπεία για τον ΣΔΤ2 με τη δυνατότητα να παρέχει καρδιαγγειακή προστασία σε αυτόν τον πληθυσμό ασθενών. Τροποποιήσεις στο μόριο της σεμαγλουτίδης παρατείνουν τον χρόνο ημιζωής του μορίου και το προστατεύουν από την αποικοδομητική δράση του ενζύμου της διπεπτιδυλικής πεπτιδάσης-4. Στην υψηλότερη δόση των 2,4 mg, η σεμαγλουτίδη έχει εγκριθεί για χρήση στην Ευρώπη και στις ΗΠΑ ως η πρώτη εβδομαδιαίως χορηγούμενη ενέσιμη θεραπεία στα πλαίσια της χρόνιας διαχείρισης βάρους σε ενήλικα άτομα. Πρόσφατα, ο FDA ενέκρινε τη σεμαγλουτίδη στη δόση των 2,4 mg με ένδειξη τη θεραπεία της παχυσαρκίας σε έφηβα άτομα ηλικίας 12 ετών και άνω. Μεταξύ των επί του παρόντος εγκεκριμένων παραγόντων κατά της παχυσαρκίας (Πίνακας 1), η σεμαγλουτίδη (2,4 mg) είναι ο πιο δραστικός, σχετιζόμενη με μέση προσαρμοσμένη (για το εικονικό φάρμακο) απώλεια σωματικού βάρους της τάξης του 12,4% στο 1 έτος θεραπείας.
Η αποτελεσματικότητά της σεμαγλουτίδης έχει δοκιμαστεί ως ένα συμπληρωματικό μέσο στις υγιεινοδιαιτικές παρεμβάσεις στο πλαίσιο του ολοκληρωμένου προγράμματος κλινικών δοκιμών STEP, που περιλαμβάνει συνολικά 18 δοκιμές. Ο πυρήνας του προγράμματος STEP αποτελείται από οκτώ διεθνείς (STEP 1-5, STEP 8-10) και τρεις περιφερειακές (STEP 6-7, STEP 11) μελέτες, ενώ πρόσθετες δοκιμές επικεντρώνονται στη διαχείριση βάρους σε έφηβα άτομα (δοκιμή STEP TEENS) και/ή σε παιδιά (δοκιμή STEP Young), σε ασθενή άτομα με καρδιακή ανεπάρκεια με διατηρημένο κλάσμα εξώθησης και χωρίς ή με σακχαρώδη διαβήτη (δοκιμές STEP-HFpEF, STEP-HFpEF DM), σε άτομα με παχυσαρκία χωρίς ΣΔΤ2 (δοκιμή STEP UP) και με ΣΔΤ2 (δοκιμή STEP UP T2D) με χορήγηση της πολύ υψηλής δόσης σεμαγλουτίδης (7,2 mg εβδομαδιαίως), καθώς και στην έκβαση καρδιαγγειακών συμβαμάτων (δοκιμή SELECT). Τα αποτελέσματα αυτών των μελετών συνοψίζονται στον Πίνακα 2.
Μεταξύ των βασικών γνώσεων που αποκομίστηκαν από το πρόγραμμα κλινικών δοκιμών STEP, η σημαντική απώλεια βάρους είναι δυνατή με τη σεμαγλουτίδη (2,4 mg) σε ενήλικα (δοκιμή STEP 1) και έφηβα άτομα (STEP TEENS) με παχυσαρκία, ανεξάρτητα από το φυλετικό τους υπόβαθρο (STEP 6). Η συντριπτική πλειονότητα των ενηλίκων ατόμων που συμμετείχαν στο πρόγραμμα (μεταξύ 77% και 89%) πέτυχαν κλινικά σημαντική μείωση βάρους τουλάχιστον 5%. Αξιοσημείωτα, απώλεια βάρους του 20%, στόχος που μέχρι τότε ήταν εφικτός μόνο με βαριατρική χειρουργική, επιτεύχθηκε σχεδόν από το 1/3 των συμμετεχόντων ατόμων που έλαβαν θεραπεία με σεμαγλουτίδη σε σύγκριση με λίγο περισσότερο από 1% αυτών που έλαβαν το εικονικό φάρμακο. Η μείωση βάρους σταθεροποιήθηκε μετά από περίπου 60 εβδομάδες μετά την έναρξη της θεραπείας και διατηρήθηκε μετά από >2 χρόνια θεραπείας (δοκιμή STEP 5). Ωστόσο, σε περιπτώσεις που η θεραπεία διεκόπη, το χαμένο βάρος ανακτήθηκε σταδιακά (δοκιμή STEP 4, επέκταση δοκιμής STEP 1), υπογραμμίζοντας την αναγκαιότητα συνεχιζόμενης φαρμακοθεραπείας κατά της παχυσαρκίας για παρατεταμένο όφελος. Η συμπερίληψη της εντατικής συμπεριφορικής θεραπείας (διατροφή μειωμένων θερμίδων, σωματική δραστηριότητα και ατομική εντατική συμβουλευτική) στην υψηλή δόση σεμαγλουτίδης απέτυχε να συμβάλλει σε σημαντική πρόσθετη απώλεια βάρους (δοκιμή STEP 3) πέρα από αυτή που επιτυγχάνεται με σεμαγλουτίδη και λιγότερο εντατική παρέμβαση στον τρόπο ζωής (STEP 1). Σε άτομα με ΣΔΤ2, η αύξηση της δόσης της σεμαγλουτίδης από την εγκεκριμένη δόση του 1,0 mg σε 2,4 mg απέδωσε σημαντικά μεγαλύτερη απώλεια βάρους και, σημαντικά, μόνο μία μικρή σταδιακή βελτίωση των γλυκαιμικών μεταβλητών (STEP 2). Τέλος, η υπεροχή της υψηλής δόσης σεμαγλουτίδης έναντι της ημερήσιας λιραγλουτίδης (o άλλος εγκεκριμένος GLP-1RA για τη διαχείριση της παχυσαρκίας), επιβεβαιώθηκε σε μια δοκιμή που συνέκρινε τα δύο φάρμακα απευθείας (STEP 8).
Σετμελανοτίδη
Το «ορφανό φάρμακο» σετμελανοτίδη είναι μια άλλη πρόσφατη προσθήκη στη λίστα των εγκεκριμένων φαρμάκων για τη χρόνια διαχείριση βάρους σε ενήλικα άτομα και παιδιά ηλικίας 6 ετών και άνω. Είναι ένα εξαιρετικά εκλεκτικός αγωνιστής του MC4R ο οποίος ενδείκνυται για τη θεραπεία της παχυσαρκίας που προκύπτει από διαταραχές ανεπάρκειας στο μονοπάτι MC4R. Αυτές περιλαμβάνουν την ανεπάρκεια της POMC, την ανεπάρκεια της πρωτεΐνης PCSK1 (Proprotein Convertase Subtilisin/Kexin type 1) ή την ανεπάρκεια του υποδοχέα της λεπτίνης (leptin receptor, LEPR). Τα άτομα με αυτές τις σπάνιες γενετικές αλλοιώσεις αναπτύσσουν σοβαρή πρώιμη παχυσαρκία λόγω ανεπαρκούς ενεργειακής ομοιόστασης. H σετμελανοτίδη αντιμετωπίζει την υποκείμενη υπερφαγία και τους συγκεκριμένους μοριακούς μηχανισμούς αυτών των σπάνιων γενετικών παθήσεων, με την ενεργοποίηση του MC4R με αποτέλεσμα την καταστολή της πείνας, τον αυξημένο κορεσμό και την ενίσχυση της ενεργειακής δαπάνης. Δεδομένης της σπανιότητας αυτών των τριών συνδρόμων, η σετμελανοτίδη εγκρίθηκε χωρίς να έχουν πραγματοποιηθεί μακροχρόνιες ελεγχόμενες με εικονικό φάρμακο μελέτες, αλλά βάσει δεδομένων μελετών που απέδειξαν τη σημαντική μείωση του σωματικού βάρους με σετμελανοτίδη.
Η ρυθμιστική έγκριση της σετμελανοτίδης βασίζεται σε δύο μελέτες διάρκειας ενός έτους σε 21 ασθενή άτομα με σοβαρή παχυσαρκία που προκαλείται από ανεπάρκεια είτε των POMC/PCKS1 ή του LEPR. Περίπου στο 1 έτος της θεραπείας με σετμελανοτίδη, το 80% των συμμετεχόντων ατόμων με ανεπάρκεια των POMC/PCSK1 και το 45% αυτών με ανεπάρκεια του LEPR, πέτυχε απώλεια βάρους της τάξης του τουλάχιστον 10%. Αξιολογήσεις του αισθήματος της πείνας πραγματοποιήθηκαν σε συμμετέχοντα άτομα 12 ετών και άνω, με το αίσθημα της πείνας να μειώνεται σημαντικά, κατά 27,1% στη δοκιμή POMC και κατά 43,7% στη δοκιμή LEPR, ωστόσο με μεγάλη διακύμανση μεταξύ των συμμετεχόντων ατόμων. Στην υψηλή της δόση, η σετμελανοτίδη σε συνδυασμό με τη βελτίωση των σχετικών καρδιομεταβολικών παραμέτρων οδήγησε σε απώλεια βάρους της τάξης του 15%.
Είναι αξιοσημείωτο ότι η σετμελανοτίδη έχει εγκριθεί για τη θεραπεία της παχυσαρκίας και τον έλεγχο της πείνας μόνο σε ασθενή άτομα με αποδεδειγμένη παθογόνο παραλλαγή των γονιδίων POMC, PCSK1 ή LEPR, η οποία έχει επιβεβαιωθεί με γενετικό έλεγχο. Επιπλέον, η μακροχρόνια θεραπεία με τον παράγοντα είναι απαραίτητη, καθώς η σετμελανοτίδη αντιμετωπίζει τα συμπτώματα αλλά όχι την υποκείμενη γενετική αιτία της νόσου. Αν και η σετμελανοτίδη περιορίζεται στη θεραπεία μιας μειοψηφίας ασθενών με μονογονιδιακή παχυσαρκία, είναι μια σημαντική προσθήκη στο οπλοστάσιο των φαρμακευτικών παραγόντων για τη διαχείριση του βάρους.

b Ποσοστά των συμμετεχόντων ατόμων που πέτυχαν απώλεια βάρους ≥5% από την αρχή (Εβδομάδα 0) έως την 68η εβδομάδα με συνεχόμενη σεμαγλουτίδη έναντι εικονικού φαρμάκου.
c 12 έως <18 ετών με δείκτη μάζας σώματος ≥ του 95ου εκατοστημορίου, ή ≥ του 85ου εκατοστημορίου με τη ταυτόχρονη παρουσία μίας πάθησης που σχετίζεται με το αυξημένο βάρος.
d Αλλαγή επί του δείκτη μάζας σώματος.
Φαρμακευτικές επιλογές του (άμεσου) μέλλοντος
Μέχρι την έγκριση της σεμαγλουτίδης για τη διαχείριση της παχυσαρκίας, οι συμβατικές φαρμακοθεραπείες παρείχαν μία μέτρια και παροδική απώλεια βάρους έως και 10,9% από το αρχικό σωματικό βάρος. Η σεμαγλουτίδη επιτυγχάνει μέση μείωση βάρους κατά 14,9%, προσφέροντας σημαντικά οφέλη όταν πρόκειται για επιπλοκές που σχετίζονται με το βάρος. Ωστόσο, οι δοσοεξαρτώμενες γαστρεντερικές ανεπιθύμητες ενέργειες περιορίζουν την αποτελεσματικότητα των GLP-1RAs και αποτρέπουν την περαιτέρω αύξηση της δόσης που ενδέχεται να οδηγήσει σε πρόσθετη απώλεια βάρους. Από την άλλη, οι σύγχρονες χειρουργικές προσεγγίσεις έχουν ως αποτέλεσμα σημαντική και διαρκή απώλεια βάρους κατά περίπου 30% στο 1 έτος, αναδεικνύοντας ένα χάσμα μεταξύ της απώλειας βάρους που επιτυγχάνεται με τις τρέχουσες διαθέσιμες φαρμακοθεραπείες και τη χειρουργική διαχείριση της παχυσαρκίας. Η γεφύρωση αυτού του χάσματος και η μείωση του σωματικού βάρους κατά περισσότερο από 20% αντιπροσωπεύει ένα άτυπο σημείο αναφοράς για τις αναδυόμενες θεραπείες κατά της παχυσαρκίας που βρίσκονται στο τελευταίο στάδιο της κλινικής ανάπτυξής τους (Εικόνα 1). Μεταξύ αυτών, η τιρζεπατίδη (tirzepatide) είναι ο παράγοντας που υπόσχεται περαιτέρω διαφοροποίηση της διαχείρισης της παχυσαρκίας στο όχι και τόσο μακρινό μέλλον.

Η τιρζεπατίδη είναι ένα συνθετικό γραμμικό πεπτίδιο που βασίζεται στην αλληλουχία του εγγενούς εξαρτώμενου από τη γλυκόζη ινσουλινοτρόπου πολυπεπτιδίου (glucose-dependent insulinotropic polypeptide, GIP), η οποία έχει διπλή αγωνιστική δραστικότητα στα μονοπάτια GIP και GLP-1. Τόσο το GIP όσο και το GLP-1 είναι ορμόνες ινκρετίνης που παράγονται από το έντερο, οι οποίες ενορχηστρώνουν τη μεταγευματική γλυκόζη και των μεταβολισμό των λιπιδίων. Η τιρζεπατίδη αναπτύχθηκε για να καθοριστεί εάν το GIP θα μπορούσε να ενισχύσει την επίδραση των GLP-1Ras στη μείωσης της γλυκόζης σε άτομα με σακχαρώδη διαβήτη, κάτι που μελετήθηκε εκτενώς στο πρόγραμμα κλινικών δοκιμών SURPASS σε ενήλικα άτομα με ΣΔΤ2.
Οι πέντε δοκιμές SURPASS αξιολόγησαν τις δόσεις των 5, 10 και 15 mg της τιρζεπατίδης, χορηγούμενες μία φορά την εβδομάδα, είτε ως μονοθεραπεία είτε ως πρόσθετη θεραπεία σε άλλα φάρμακα για τον σακχαρώδη διαβήτη, και συνέκριναν την αποτελεσματικότητά της με εικονικό φάρμακο, σεμαγλουτίδη του 1,0 mg και δύο ανάλογα ινσουλίνης μακράς δράσης. Σε όλες τις δοκιμές, η υψηλότερη δόση τιρζεπατίδης μείωσε την HbA1c έως και 1,6% περισσότερο από το εικονικό φάρμακο. Ως αποτέλεσμα αυτών των κλινικών ευρημάτων, το 2022, ο FDA και ο EMA ενέκριναν την τιρζεπατίδη ως παράγοντα μείωσης της γλυκόζης, χορηγούμενη υποδόρια μία φορά την εβδομάδα, σε ενήλικα άτομα με ΣΔΤ2 σε συνδυασμό με υγιεινοδιαιτητικές παρεμβάσεις (δίαιτα και άσκηση). Εκτός από τον ισχυρό γλυκαιμικό έλεγχο, η θεραπεία με την τιρζεπατίδη επέδειξε εμφανή και κλινικά σημαντική επίδραση στο σωματικό βάρος με δοσοεξαρτώμενο τρόπο, με τη μέση προσαρμοσμένη (για το εικονικό φάρμακο) απώλεια βάρους να κυμαίνεται στο 7,0%, 8,6% και 10,9% με τις δόσεις των 5, 10 και 15 mg, αντίστοιχα.
Η αποτελεσματικότητα και η ασφάλεια της τιρζεπατίδης σε ενήλικα άτομα με παχυσαρκία εν απουσία σακχαρώδους διαβήτη αξιολογείται επί του παρόντος στο πρόγραμμα κλινικών δοκιμών SURMOUNT, το οποίο αποτελείται από έξι διεθνείς και δύο περιφερειακές δοκιμές (Πίνακας 3). Μέχρι σήμερα, τα ευρήματα μίας μόνο μελέτης, της SURMOUNT-1, έχουν δημοσιευτεί. Σε αυτή τη δοκιμή, διερευνήθηκε η αποτελεσματικότητα και η ασφάλεια της τιρζεπατίδης έναντι του εικονικού φαρμάκου σε περισσότερα από 2.500 ενήλικα άτομα με παχυσαρκία ή σε άτομα με υπερβολικό βάρος συν τουλάχιστον μία επιπλοκή που σχετίζεται με το βάρος, εξαιρουμένων των τεστ διαβήτη. Στις 72 εβδομάδες, η εβδομαδιαία δόση τιρζεπατίδης των 5 mg, 10 mg ή 15 mg οδήγησε σε σημαντική μέση απώλεια βάρους της τάξης του 15,0%, 19,5% και 20,9%, αντίστοιχα, σε σύγκριση με 3,1% με εικονικό φάρμακο σε συνδυασμό με υγιεινοδιαιτικές παρεμβάσεις. Επιτεύχθηκε κλινικά σημαντική απώλεια βάρους ≥5%, από το 85%, το 89% και το 91% των συμμετεχόντων ατόμων που έλαβε κάθε μία από τις τρεις δόσεις της τιρζεπατίδης (5 mg, 10 mg ή 15 mg, αντίστοιχα), αποτελέσματα που είναι ανώτερα από αυτό του εικονικού φαρμάκου (35%).
Η τιρζεπατίδη είναι η πρώτη από τις πολλαπλές θεραπείες επόμενης γενιάς για τη διαχείριση της παχυσαρκίας που βρίσκονται υπό κλινική ανάπτυξη, με πολλές από αυτές να βασίζονται στην αγωνιστική δράση έναντι του υποδοχέα του GLP-1. Κάποιες καινοτόμες θεραπείες βασίζονται στη χρήση συνδυασμών πεπτιδίων που δρουν συμπληρωματικά, έχοντας ως βασικό άξονα δράσης το μονοπάτι GLP-1. Αυτοί οι παράγοντες υπόσχονται περαιτέρω διαφοροποίηση των διαθέσιμων θεραπευτικών επιλογών και θα μπορούσαν να είναι στη διάθεσή μας στο άμεσο μέλλον. Με την υιοθέτηση μίας πολυτροπικής θεραπευτικής προσέγγισης με δύο ή περισσότερα φάρμακα κατά της παχυσαρκίας, τα άτομα που πάσχουν από παχυσαρκία ενδέχεται στο μέλλον να μπορούν να επιτύχουν απώλεια βάρους της τάξης του 25% ή ακόμα και 30%, κάτι που προηγουμένως ήταν εφικτό μόνο με τη βαριατρική χειρουργική. Κατά αυτόν τον τρόπο, θεραπεύοντας την παχυσαρκία, θα είναι εφικτή η αντιμετώπιση της βασικής αιτίας ενός ολόκληρου φάσματος «παθήσεων παχυσαρκίας» και η επίτευξη του απώτερου στόχου της αποτελεσματικής διαχείρισης βάρους και της βελτίωσης της υγείας για πολλούς συνανθρώπους μας.















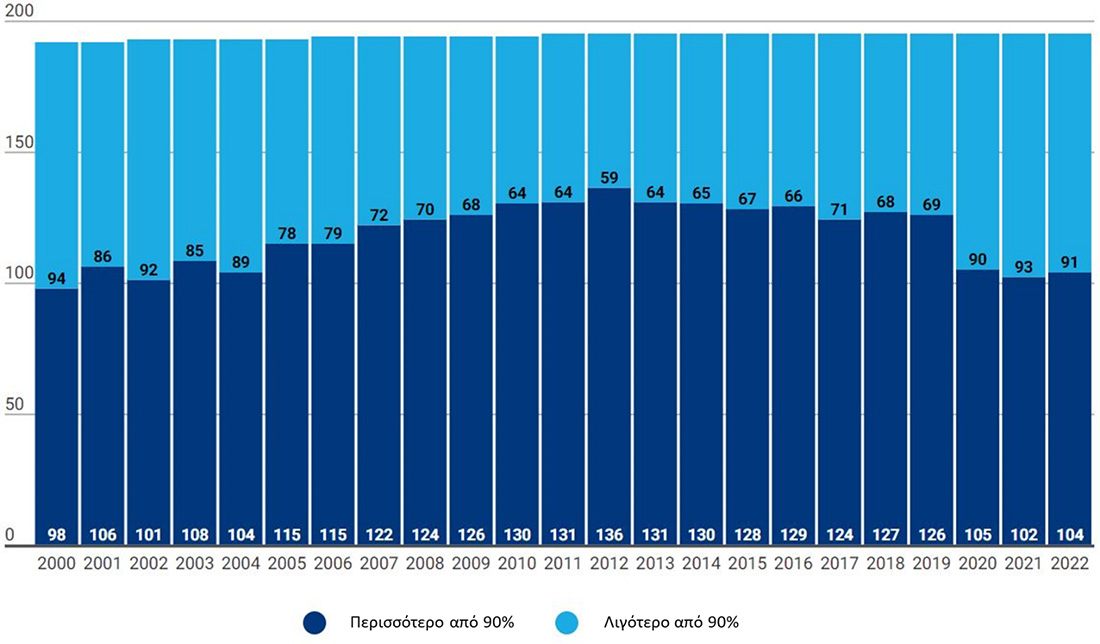
 Η παγκόσμια εμβολιαστική κάλυψη το έτος 2022 ανά ασθένεια
Η παγκόσμια εμβολιαστική κάλυψη το έτος 2022 ανά ασθένεια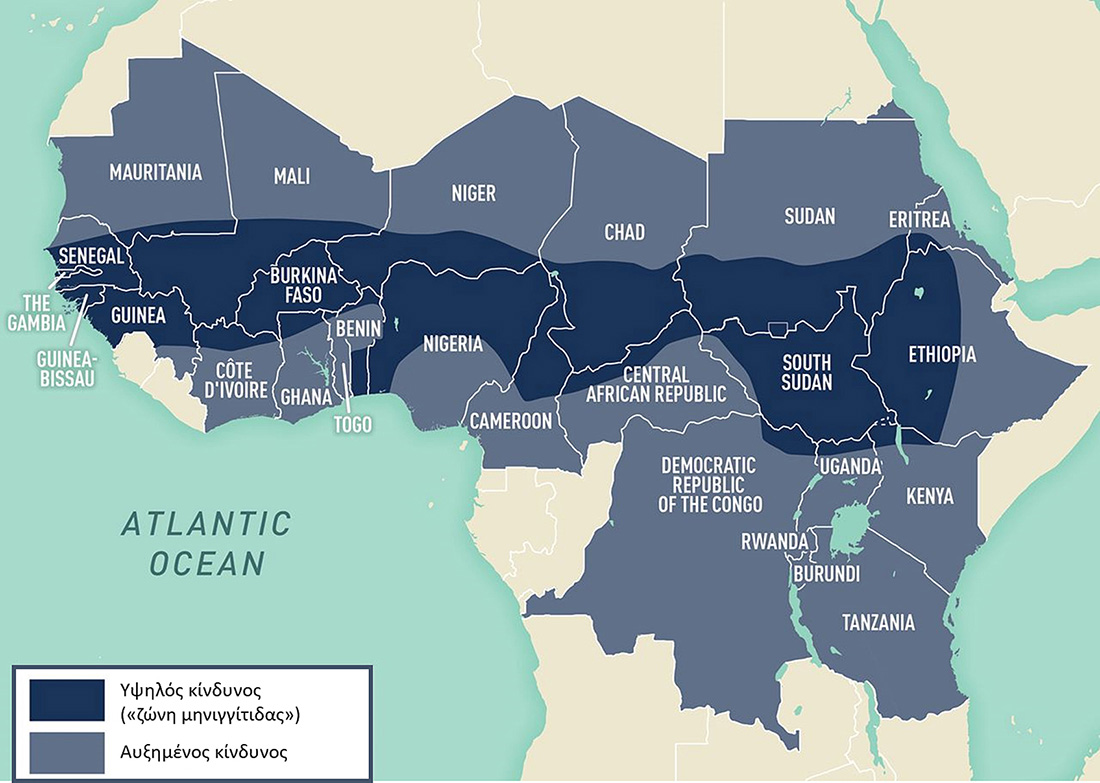




 Στους γενετικούς παράγοντες κινδύνου περιλαμβάνονται επίσης, τα αυξημένα επίπεδα δραστικότητας FVIII (η μέτρησή του όμως δεν συνιστάται στον έλεγχο ρουτίνας), η δυσιδωνογοναιμία, η Non-O ομάδα αίματος (συνοδεύεται κατά 25% από υψηλότερα επίπεδα FVIII και vWF) και η υπερομοκυστεϊναιμία. Έχουν επίσης προσφάτως προσδιορισθεί και άλλοι επίτοποι σχετιζόμενοι με ανάπτυξη ΦΘΝ, όπως οι TSPAN15 και SLC44A2. Η ανίχνευση της ετερόζυγης ή ομόζυγης μετάλλαξης της methylenetetrahydrofolate reductase (MTHFR) C677Τ που στο παρελθόν θεωρούνταν ως παράγοντας θρομβοφιλίας, δεν έχει επιβεβαιωθεί ως παράγοντας κινδύνου για την πρώτη ΦΘΝ ή για υποτροπή της και ο προσδιορισμός της δεν θεωρείται πλέον απαραίτητος. Μπορεί να αποτελεί αιτία υπερομοκυστεϊναιμίας και συνοδεύεται συνήθως από χαμηλά επίπεδα φυλλικού οξέος. Η αύξηση επιπέδων ομοκυστεΐνης φαίνεται σε μερικές μελέτες να αυξάνει τον κίνδυνο ΦΘΝ, οπότε τα επίπεδά της μπορεί να βελτιωθούν με χορήγηση φυλλικού οξέος και βιταμινών του συμπλέγματος Β.
Στους γενετικούς παράγοντες κινδύνου περιλαμβάνονται επίσης, τα αυξημένα επίπεδα δραστικότητας FVIII (η μέτρησή του όμως δεν συνιστάται στον έλεγχο ρουτίνας), η δυσιδωνογοναιμία, η Non-O ομάδα αίματος (συνοδεύεται κατά 25% από υψηλότερα επίπεδα FVIII και vWF) και η υπερομοκυστεϊναιμία. Έχουν επίσης προσφάτως προσδιορισθεί και άλλοι επίτοποι σχετιζόμενοι με ανάπτυξη ΦΘΝ, όπως οι TSPAN15 και SLC44A2. Η ανίχνευση της ετερόζυγης ή ομόζυγης μετάλλαξης της methylenetetrahydrofolate reductase (MTHFR) C677Τ που στο παρελθόν θεωρούνταν ως παράγοντας θρομβοφιλίας, δεν έχει επιβεβαιωθεί ως παράγοντας κινδύνου για την πρώτη ΦΘΝ ή για υποτροπή της και ο προσδιορισμός της δεν θεωρείται πλέον απαραίτητος. Μπορεί να αποτελεί αιτία υπερομοκυστεϊναιμίας και συνοδεύεται συνήθως από χαμηλά επίπεδα φυλλικού οξέος. Η αύξηση επιπέδων ομοκυστεΐνης φαίνεται σε μερικές μελέτες να αυξάνει τον κίνδυνο ΦΘΝ, οπότε τα επίπεδά της μπορεί να βελτιωθούν με χορήγηση φυλλικού οξέος και βιταμινών του συμπλέγματος Β.



