Το πάγκρεας είναι ένα σπογγώδες όργανο μήκους περίπου 15 εκατοστών, που βρίσκεται στο άνω μέρος της κοιλιακής χώρας μεταξύ του στομάχου και της σπονδυλικής στήλης. Ένα υγιές, φυσιολογικό πάγκρεας αποτελείται από διάφορους τύπους κυττάρων και συγκεκριμένα από κυψελιδικά κύτταρα που εκκρίνουν πεπτικά ένζυμα (acinar cells), κύτταρα που εκκρίνουν διττανθρακικό νάτριο (ductal cells), κύτταρα που βρίσκονται στη μεταβατική ζώνη μεταξύ των περιοχών που βρίσκονται οι δύο προηγούμενες κατηγορίες κυττάρων (centro-acinar cells), ενδοκρινικά κύτταρα που εκκρίνουν ορμόνες, και τα σχετικά ανενεργά αστεροειδή κύτταρα. Ο παγκρεατικός καρκίνος εμφανίζεται όταν μία αλληλουχία μεταλλαγών του DNA των παγκρεατικών κυττάρων οδηγεί στην ανεξέλεγκτη κυτταρική ανάπτυξη και τον πολλαπλασιασμό τους, σχηματίζοντας τελικά όγκους.
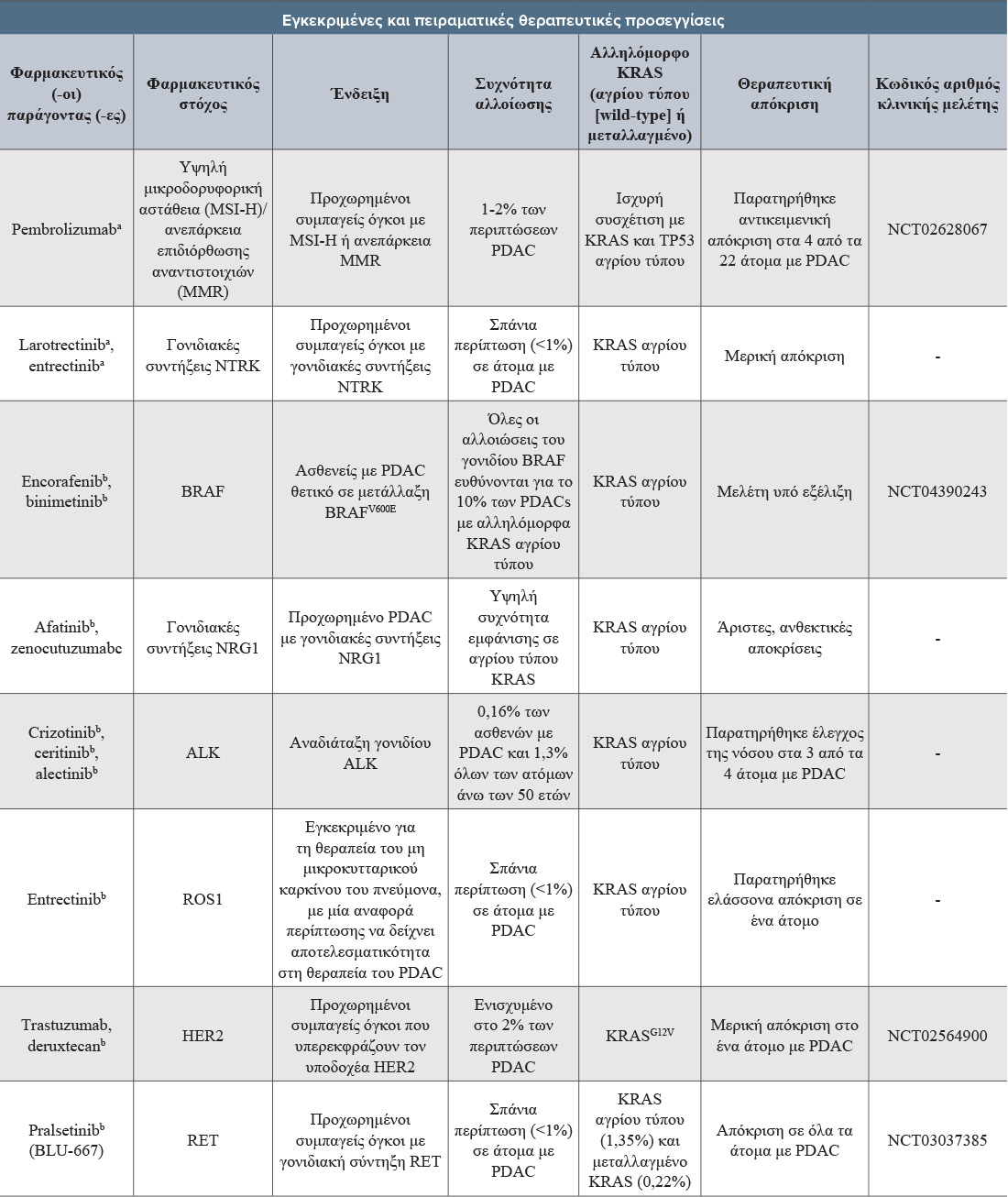
Ο καρκίνος του παγκρέατος είναι ο δωδέκατος πιο κοινός καρκίνος σε όλο τον κόσμο, με καταγεγραμμένες περισσότερες από 495.000 νέες περιπτώσεις το έτος 2020. Στην Ελλάδα, ο παγκρεατικός καρκίνος ήταν ο έκτος πιο κοινός και ο τέταρτος πιο θανατηφόρος καρκίνος το 2020, αντιπροσωπεύοντας το 3,4% και 3,8% των συνολικών περιπτώσεων καρκίνου στους άντρες και τις γυναίκες, αντίστοιχα. Την ίδια χρονιά, καταγράφηκαν 2.302 νέες περιπτώσεις παγκρεατικού καρκίνου.
Παγκοσμίως, το πορογενές αδενοκαρκίνωμα του παγκρέατος (pancreatic ductal adenocarcinoma, PDAC), ένας τύπος καρκίνου που συνιστά την πλειοψηφία (90%) των περιπτώσεων των παγκρεατικών νεοπλασμάτων, ήταν η έβδομη κυριότερη αιτία θανάτου από καρκίνο το 2020. Στις ΗΠΑ, η συχνότητα του PDAC αυξάνεται κατά 0,5% έως 1,0% ανά χρόνο και εκτιμάται ότι θα αποτελέσει τη δεύτερη κυριότερη αιτία θνησιμότητας από καρκίνο έως το 2030 τόσο στις ΗΠΑ όσο και την Ευρωπαϊκή Ένωση, στην οποία το PDAC ήταν η τρίτη κυριότερη αιτία θανάτου από καρκίνο το 2020.
Εκτός του αδενοκαρκινώματος του παγκρέατος (PDAC), άλλοι πιο σπάνιοι ιστολογικοί τύποι παγκρεατικού καρκίνου είναι το κυψελιδικό καρκίνωμα και το παγκρεατοβλάστωμα που εμφανίζονται στην εξωκρινή μοίρα του παγκρέατος και οι νευροενδοκρινείς όγκοι που αναπτύσσονται στην ενδοκρινή μοίρα.
Στο παρόν άρθρο θα εστιάσουμε στο αδενοκαρκίνωμα του παγκρέατος (PDAC), και αφού γίνει μια παρουσίαση κάποιων γενικών στοιχείων και χαρακτηριστικών του, θα αναφερθούμε συνοπτικά στην καθιερωμένη θεραπεία και τις πρόσφατες εξελίξεις των μοριακά στοχευμένων θεραπειών του PDAC.
Παράγοντες κινδύνου εμφάνισης παγκρεατικού αδενοκαρκινώματος
Η εμφάνιση του PDAC έχει συσχετιστεί με τροποποιήσιμους και κληρονομήσιμους παράγοντες κινδύνου, οι οποίοι είναι οι εξής:
Οικογενειακό ιστορικό καρκίνου του παγκρέατος.
-
Γράφημα 1. Παγκόσμιες αναλογίες επίπτωσης, τυποποιημένες κατά ηλικία, για τον παγκρεατικό καρκίνο το 2020 (και τα δύο φύλα, όλες οι ηλικίες) Κάπνισμα. Συγκεκριμένα, το ενεργό κάπνισμα έχει δειχθεί ότι έχει τον πιο ισχυρό συσχετισμό με την εμφάνιση PDAC μεταξύ των παραγόντων τρόπου ζωής, σύμφωνα με τα αποτελέσματα μίας μετα-ανάλυσης 12 μελετών ασθενών-μαρτύρων (case-control) που συμπεριέλαβε 6.507 ασθενείς και 12.890 μάρτυρες (αναλογία πιθανοτήτων [odds ratio]: 1,74, 95% διάστημα εμπιστοσύνης [confidence interval, CI] 1,61-1,87).
- Υπερβολική κατανάλωση αλκοόλ. Βάσει των αποτελεσμάτων μίας μετα-ανάλυσης 19 προοπτικών μελετών (δεδομένα από 4.211.129 άτομα), η ημερήσια κατανάλωση αλκοόλ άνω των 30 γραμμαρίων συσχετίστηκε ήπια με την εμφάνιση PDAC (σχετικός κίνδυνος [relative risk, RR]: 1,22, 95% CI, 1,03-1,45).
-
Γράφημα 2. Παγκόσμιες αναλογίες θνησιμότητας, τυποποιημένες κατά ηλικία, για τον παγκρεατικό καρκίνο το 2020 (και τα δύο φύλα, όλες οι ηλικίες) Παχυσαρκία. Μία Νορβηγική ανάλυση 940.060 ατόμων βρήκε ότι τα παχύσαρκα άτομα διατρέχουν αυξημένο κίνδυνο εμφάνισης PDAC (RR: 1,54 [95% CI, 1,04-2,29]).
- Χρόνια παγκρεατίτιδα. Μία μετα-ανάλυση 14 προοδευτικών μελετών κοόρτης που συμπεριέλαβαν συνολικά 862.664 άτομα έδειξε ότι η χρόνια παγκρεατίτιδα σχετίζεται με μία σημαντική αύξηση του κινδύνου εμφάνισης PDAC κατά 13 φορές (RR: 13,3 [95% CI, 6,1-28,9]).
- Συγκεκριμένες γενετικές παθήσεις που σχετίζονται με τα γονίδια BRCA1, BRCA2, PALB2, ATM, MLH1, MSH2, MSH6 και PMS2. Έχει δειχθεί ότι 3,8% με 9,7% των ασθενών με PDAC έχουν παθογόνες παραλλαγές γονιδίων βλαστικής σειράς που αυξάνουν την προδιάθεση εμφάνισης PDAC. Σύμφωνα με τις κατευθυντήριες οδηγίες του Αμερικανικού National Comprehensive Cancer Network συνίσταται ο έλεγχος όλων των ασθενών που διαγιγνώσκονται με PDAC για παραλλαγές γονιδίων συμπεριλαμβανομένων των BRCA1/2, ATM, MLH1, MSH2, MSH6 και PMS2.
Επίσης, είναι αξιοσημείωτη η αύξηση της ετήσιας επίπτωσης του PDAC στα νεαρότερα άτομα, όπως ανέδειξε μία μελέτη που χρησιμοποίησε δεδομένα από το έτος 1995 έως το 2014 στις ΗΠΑ. Σύμφωνα με τους ερευνητές, αυτό το εύρημα πιθανόν να συνδέεται με τα αυξανόμενα ποσοστά παχυσαρκίας και διαβήτη, υπογραμμίζοντας περαιτέρω τη σημασία που έχει η υιοθέτηση ενός υγιεινού τρόπου ζωής στην πρόληψη του PDAC.
 Κλινικές εκδηλώσεις του αδενοκαρκινώματος του παγκρέατος
Κλινικές εκδηλώσεις του αδενοκαρκινώματος του παγκρέατος
Τα συμπτώματα κατά την εμφάνιση του PDAC συχνά είναι ασαφή και μη συγκεκριμένα. Αυτά μπορεί να περιλαμβάνουν ίκτερο, ανοιχτόχρωμα περιττώματα, σκουρόχρωμα ούρα, πόνο στην άνω ή μέση κοιλιακή χώρα και πλάτη, ανεξήγητη απώλεια βάρους και όρεξης για φαγητό και αίσθημα βαριάς κόπωσης. Κατά τη διάγνωση, τα περισσότερα άτομα με PDAC παρουσιάζουν είτε τοπικά προχωρημένο (μη εξαιρέσιμος) ή μεταστατικό καρκίνο. Στην πλειοψηφία των περιπτώσεων, οι όγκοι εμφανίζονται στην κεφαλή του παγκρέατος και συχνά προκαλούν απόφραξη των χοληφόρων οδών με συνοδά συμπτώματα όπως σκουρόχρωμα ούρα, ίκτερο, απώλεια όρεξης, αίσθημα κόπωσης, απώλεια βάρους και ανεπάρκεια της εξωκρινούς λειτουργίας του παγκρέατος. Σε αντίθεση, τα άτομα με καρκίνο στο σώμα ή την ουρά του παγκρέατος εκδηλώνουν πιο ασαφή και μη συγκεκριμένα συμπτώματα, όπως πόνο στην κοιλιακή χώρα και την πλάτη και συμπτώματα που σχετίζονται με καχεξία (απώλεια όρεξης και βάρους, κόπωση). Η εμφάνιση σακχαρώδους διαβήτη ή η επιδείνωση προϋπάρχουσας διαβητικής νόσου μπορεί να είναι ένα σημάδι εκδήλωσης του PDAC και χρήζει ενδελεχούς αξιολόγησης. Σπάνια, η οξεία παγκρεατίτιδα μπορεί να αποτελέσει την πρωταρχική εκδήλωση του PDAC και εκδηλώνεται σε περίπου 3% των νεοδιαγνωσθέντων ασθενών με PDAC.
Αντιμετώπιση του παγκρεατικού αδενοκαρκινώματος
Η καθιερωμένη θεραπεία του παγκρεατικού καρκίνου συνήθως περιλαμβάνει χειρουργική αφαίρεση, χημειοθεραπεία και/ή ακτινοθεραπεία. Η χειρουργική εκτομή παραμένει η κύρια μέθοδος θεραπείας, ωστόσο αυτή είναι εφικτή μόνο κατά τα αρχικά στάδια του PDAC. Καθώς δεν υπάρχουν αποτελεσματικές εξετάσεις που να ανιχνεύουν το PDAC σε πρώιμο στάδιο και η πλειοψηφία (80%) των ασθενών διαγιγνώσκονται με την πάθηση σε προχωρημένο στάδιο, η χειρουργική εκτομή συνήθως δεν αποτελεί θεραπευτική επιλογή για αυτά τα άτομα. Ως εκ τούτου, ο παγκρεατικός καρκίνος δεν έχει καλή πρόγνωση και μόλις 10% των ασθενών επιβιώνουν για περισσότερο από πέντε χρόνια. Εκτός από την εξαιρεσιμότητα του PDAC, η γενική κατάσταση των ασθενών είναι ένας άλλος παράγοντας που καθορίζει την επιλογή της θεραπευτικής προσέγγισης. Στον πίνακα 1, συνοψίζονται οι θεραπευτικές επιλογές και η πρόγνωση ανάλογα με το στάδιο του παγκρεατικού καρκίνου.
Μοριακό προφίλ του αδενοκαρκινώματος του παγκρέατος
Η παθοφυσιολογία του PDAC χαρακτηρίζεται από πολύπλοκες γενετικές αλλοιώσεις οι οποίες συμβαίνουν σε πολλαπλά στάδια. Κατά το προκαρκινικό στάδιο, ενδοεπιθηλιακές νεοπλασίες αποκτούν αθροιστικές γενετικές αλλοιώσεις σε ογκογονίδια που είναι υπεύθυνα για την έναρξη και τη διατήρηση της εκδήλωσης του PDAC, συμπεριλαμβανομένων των KRAS, CDKN2A, TP53 και SMAD4. Συγκεκριμένα, οι μεταλλαγές του KRAS, το οποίο εμπλέκεται στη μεταγωγή σημάτων από κινάσες υποδοχέα τυροσίνης δια μέσω του μονοπατιού MAKP, αποτελούν ένα αρχικό βήμα στην ανάπτυξη του PDAC και ανιχνεύονται σε 90-92% των ασθενών με PDAC. Αυτές οι μεταλλαγές έχει βρεθεί ότι συμβαίνουν με διαφορετική συχνότητα σε συγκεκριμένα σημεία του γονιδίου KRAS και περιλαμβάνουν τις ακόλουθες: G12D (συχνότητα εμφάνισης: 41%), G12V (34%), G12R (16%), Q61H (4%) και G12C (~1%).
Καθώς οι ενδοεπιθηλιακές ενδοπλασίες εξελίσσονται σε σταδίου 2 ή 3, συνήθως συμβαίνουν επιπρόσθετες γονιδιακές αλλοιώσεις στα γονίδια CDKN2A, TP53 και/ή SMAD4. Εκτός αυτών, έχει βρεθεί ότι αλλοιώσεις στα γονίδια αναδιαμόρφωσης της χρωματίνης SWI/SNF απαντώνται σε περίπου 10% με 15% των PDACs.
Παράλληλα, έχουν ανιχνευθεί και άλλα μεταλλαγμένα γονίδια με συχνότητα εμφάνισης μικρότερης του 10%, συμπεριλαμβανομένων γονιδίων που κωδικοποιούν παράγοντες οι οποίοι είτε τροποποιούν τη χρωματίνη (πχ. ARID1A, KMT2D και KMT2C), είτε επιδιορθώνουν το DNA (πχ. BRCA1, BRCA2 και PALB2) είτε έχουν άλλη ογκογόνο δράση (πχ. BRAF, MYC, FGFR1).
Συνολικά, όλες αυτές οι γενετικές αλλοιώσεις συμβάλλουν στην εκδήλωση πολύπλευρων ανεπαρκειών σε ογκοκατασταλτικούς μηχανισμούς, οδηγώντας τελικά σε απορρύθμιση των κυτταρικών σηματοδοτικών μονοπατιών ανάπτυξης, ανεξέλεγκτο κυτταρικό πολλαπλασιασμό και φλεγμονή.
Νέες μοριακά στοχευμένες θεραπείες για το παγκρεατικό αδενοκαρκίνωμα
Η βελτιωμένη κατανόηση της βιολογίας και της γενετικής του PDAC έχει επηρεάσει την κλινική πρακτική τα τελευταία χρόνια, ωθώντας στην ανάδυση εξατομικευμένων θεραπειών με βάση το μοριακό προφίλ του όγκου. Κάποιες εξ αυτών έχουν ήδη εγκριθεί από τον Αμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA) και τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA), ενώ πολλές άλλες βρίσκονται υπό προκλινική ή κλινική ανάπτυξη.
Στον ακόλουθο πίνακα συνοψίζονται οι νέες χημειοθεραπευτικές προσεγγίσεις της Ιατρικής Ακριβείας (Precision Medicine) για την αντιμετώπιση του παγκρεατικού αδενοκαρκινώματος, οι οποίες στοχεύουν τις μεταλλαγμένες μορφές του γονιδίου KRAS και/ή άλλων γονιδίων (Πίνακας 2).
Να σημειωθεί ότι εκτός από τις μοριακά στοχευμένες θεραπείες που παρατίθενται παρακάτω, βρίσκονται υπό ανάπτυξη θεραπείες εμβολίων και ανοσοθεραπείες, οι οποίες δεν αποτελούν αντικείμενο εστίασης του παρόντος άρθρου (για περισσότερες πληροφορίες σχετικά με αυτές, μπορείτε να ανατρέξετε στο άρθρο των Hosein et al.).
Αν και οι πρόσφατες εξελίξεις στον τομέα των εξατομικευμένων θεραπειών αναθερμαίνουν τις ελπίδες για την εύρεση αποτελεσματικής θεραπείας του PDAC, παραμένει κρίσιμη και ανεκπλήρωτη η ανάγκη να μεταφραστεί η ολοένα και βαθύτερη κατανόηση της βιολογίας του PDAC στην κλινική πράξη ώστε να βελτιωθεί περαιτέρω η επιβίωση και η ποιότητα ζωής των ασθενών. Προς αυτή τη κατεύθυνση, κρίνεται ιδιαίτερα σημαντική από πολλούς επιστήμονες η συμμετοχή των ασθενών με παγκρεατικό καρκίνο, ακόμα και αυτών με καρκίνο αρχικού σταδίου, σε κλινικές δοκιμές.
Με αυτή την πολύτιμη συνεισφορά των ασθενών θα πλησιάσουμε ακόμα περισσότερο στη θεραπεία του παγκρεατικού καρκίνου.